Александр Артеменко - Удивительный мир органической химии
- Название:Удивительный мир органической химии
- Автор:
- Жанр:
- Издательство:Дрофа
- Год:2005
- Город:Москва
- ISBN:5-7107-9540-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Артеменко - Удивительный мир органической химии краткое содержание
Книга адресована старшеклассникам, учителям, а также тем, кто интересуется органической химией.
Удивительный мир органической химии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Вот еще интересный факт. В 1906 г. в США было основано периодическое издание журнала «Chemical abstracts», в котором регулярно публикуются сведения о новых веществах (в том числе и органических). Так вот, оказалось, что для публикации 1 млн записей о веществах потребовался 31 год, для второго миллиона — 18 лет, третьего — 7 лет, а для четвертого — всего 4 года. Вот какими темпами работают химики!
И все же, почему органических соединений так много?
Атом углерода, который является основой всех органических веществ, — особый элемент в природе. Он способен образовывать химические связи не только с другими элементами, но, что очень важно, и с другими углеродными атомами, образуя при этом разные по длине прямые и разветвленные цепи:
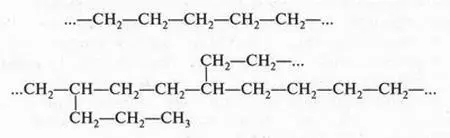
При этом образуются молекулы, содержащие от нескольких углеродных атомов до десятков, сотен и более. Углеродные атомы могут образовывать и замкнутые цепи — циклы. Например, циклогексан:
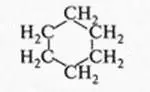
Вот почему ни один элемент в природе не может дать такого разнообразия веществ, как углерод. Довольно скромно рядом с ним выглядит кремний. Самая длинная цепочка, которую в состоянии образовать атомы кремния, содержит всего 55 атомов. Но даже для образования такой молекулы необходимы специальные условия!
Если же углеродную цепь разнообразить включением в нее других элементов, то число различных перестановок в молекуле окажется огромным. А ведь в органических соединениях содержатся не только простые связи, но и двойные и тройные. Это тоже увеличивает разнообразие органических веществ. Правда, нам могут возразить. Скажут, если неорганическая химия изучает практически все известные нам элементы, то возможность различных перестановок в неорганических веществах будет гораздо большей. И такая возможность, казалось бы, будет возрастать с ростом различных атомов. Однако это не так. Дело в том, что неорганические вещества будут прочными только в том случае, если в состав их молекул будут входить два, три, но не более десятка различных атомов. По мере присоединения все новых и новых элементов молекула становится непрочной и склонной к разрушению.
1.4. Непохожие друг на друга
Чем же отличаются органические вещества от неорганических?
Чтобы ответить на этот вопрос, проделаем очень простой опыт. Нагреем несколько кристаллов органического вещества. Даже при сравнительно невысокой температуре они начинают плавиться и переходят в жидкое состояние. Если температуру еще повысить, то эта жидкость начинает пениться (кипеть), а потом разлагаться, сгорать или обугливаться. Например, если сухую деревянную палочку внести в огонь, то она, постепенно обугливаясь, сгорает и переходит в тлеющие угли. Проделаем еще такой опыт. Возьмем пинцетом кусочек сахара и внесем его в пламя горелки. Вначале из сахара выделяются газы, затем он обугливается и сгорает.
Если охладить продукты, которые получились от сгорания палочки и сахара, то в них вы не узнаете прежние предметы.
А теперь поступим иначе. Внесем в пламя любое неорганическое вещество, например хлорид натрия. Вы увидите, что соль ведет себя совсем иначе, чем палочка и кусочек сахара. Соль выдерживает даже очень высокую температуру. Она вначале растрескивается на мелкие кусочки, а потом, если бы удалось повысить температуру до 800 °С, начинает плавиться. При 1440 °С расплавленная соль закипает. Но стоит расплавленную соль охладить, как получается тот же продукт, что был вначале. Эта соль опять пригодна для приготовления пищи!
Есть еще одно отличие между органическими и неорганическими веществами. Известно, что большинство неорганических веществ хорошо растворимо в воде. В то же время органических веществ, которые растворяются в воде, не так уж и много. Почему?
Чтобы ответить на этот вопрос, необходимо рассмотреть, как связаны между собой атомы в молекулах неорганических и органических веществ.
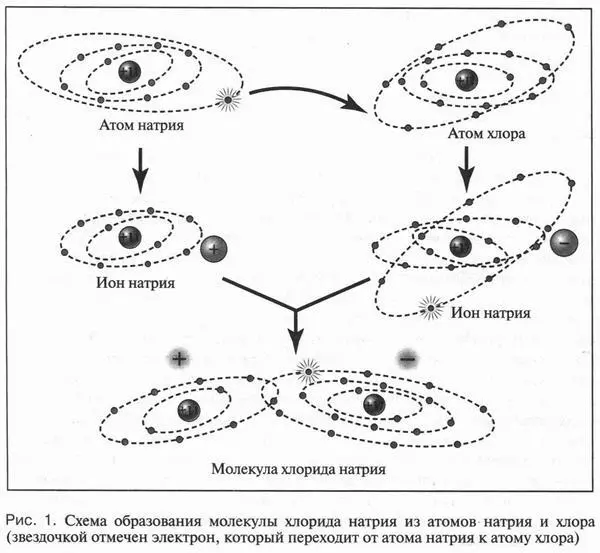
Известно, что любой атом состоит из положительно заряженного ядра, в котором сосредоточена практически вся масса атома, и отрицательно заряженных электронов, окружающих это ядро. Электроны располагаются от ядра на различных расстояниях. Группы электронов, удаленные на одинаковое расстояние от ядра и обладающие одинаковой энергией, образуют слои (оболочки). Чем дальше от ядра расположены эти слои, тем большей энергией обладают их электроны. Поскольку атом — нейтральная частица, то это означает полную компенсацию положительного заряда ядра отрицательным зарядом всех электронов, входящих в атом. Но иногда такой компенсации не происходит. Это связано с тем, что число электронов в атоме может изменяться: при определенных условиях атом способен присоединять или отдавать несколько электронов. Если атом принимает электроны, то возникает избыточный отрицательный заряд и нейтральный атом превращается в отрицательную частицу — анион. Если же атом отдает электроны, то преобладает положительный заряд ядра и образуется положительно заряженный ион — катион. Поясним это на примере образования молекулы хлорида натрия. Атом натрия при взаимодействии с атомом хлора отдает ему единственный электрон, который расположен на внешнем электронном слое. В результате у атома натрия остаются 10 электронов (всего же было 11 электронов), а у атома хлора их будет уже 18 (было 17) (рис. 1). Так как терять и приобретать электроны могут только внешние электронные слои атомов, то на этих слоях у атомов натрия и хлора остается по восемь электронов, как у инертных газов (неона, аргона и др.). Следовательно, эти слои приобретают устойчивую электронную конфигурацию. Итак, вместо нейтрального атома натрия образовался катион, а атом хлора превратился в противоположную частицу — анион. Поскольку разноименные заряды, как известно, притягиваются, то из ионов образуется молекула хлорида натрия. Связь между катионом и анионом хлора называется ионной. Молекулы, имеющие ионную связь, всегда полярны, так как в них в одной области группируются положительные заряды, а в другой — отрицательные. Теперь посмотрим, что же происходит при растворении полярной молекулы хлорида натрия в воде.
Сразу же напомним, что в молекуле воды также преобладает ионная связь. Когда же полярные молекулы воды приближаются к полярным молекулам хлорида натрия, то происходит ориентация этих молекул друг относительно друга. Они располагаются так, что к катиону натрия и аниону хлора подходят молекулы воды с противоположным знаком. В результате между молекулами воды и хлорида натрия возникает притяжение. Затем молекулы воды внедряются между ионами хлорида натрия, ослабляют связь между ними и «растаскивают» ионы натрия и хлора в разные стороны. Вот так происходит процесс растворения неорганических веществ.
Читать дальшеИнтервал:
Закладка:









