Александр Артеменко - Удивительный мир органической химии
- Название:Удивительный мир органической химии
- Автор:
- Жанр:
- Издательство:Дрофа
- Год:2005
- Город:Москва
- ISBN:5-7107-9540-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Артеменко - Удивительный мир органической химии краткое содержание
Книга адресована старшеклассникам, учителям, а также тем, кто интересуется органической химией.
Удивительный мир органической химии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Однако сложность строения молекулы белка не ограничивается только первичной структурой. Оказывается, полипептидная цепь в зависимости от первичной структуры принимает определенное расположение в пространстве. Такое пространственное расположение также бывает различным. В связи с этим различают вторичную, третичную и четвертичную структуры.
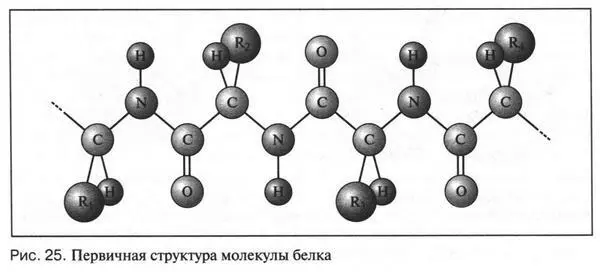
Рассмотрим вначале вторичную структуру. Как уже говорили, огромная молекула белка — не только длинная нитеобразная цепь. У многих белков эта цепь скручена в цилиндрическую спираль. Выдающийся американский химик и физик Лайнус Полинг (1901-1994)  установил в 1951 г., что полипептидная цепь α-кератина (опорный белок) имеет форму спирали (α-спираль). Такую спираль можно представить как винт с левой резьбой, у которого на один оборот приходится 3,6 остатка аминокислоты. При этом отдельные витки спирали удерживаются многочисленными водородными связями, которые образуются внутри полипептидной цепи между атомом кислорода карбонильной группы и атомом водорода аминогруппы (рис. 26). Спиральная структура имеется у многих белков. Правда, ее легко разрушить, например, нагреванием или растворителем, который сам образует водородные связи. В этом случае спираль превращается в неупорядоченный клубок.
установил в 1951 г., что полипептидная цепь α-кератина (опорный белок) имеет форму спирали (α-спираль). Такую спираль можно представить как винт с левой резьбой, у которого на один оборот приходится 3,6 остатка аминокислоты. При этом отдельные витки спирали удерживаются многочисленными водородными связями, которые образуются внутри полипептидной цепи между атомом кислорода карбонильной группы и атомом водорода аминогруппы (рис. 26). Спиральная структура имеется у многих белков. Правда, ее легко разрушить, например, нагреванием или растворителем, который сам образует водородные связи. В этом случае спираль превращается в неупорядоченный клубок.
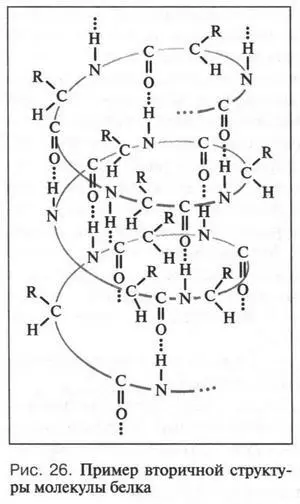
Однако закрученная в спираль полипептидная цепь может принимать в пространстве еще более сложную конфигурацию (структуру). Такая спираль способна скручиваться в клубок (рис. 27), как это происходит с новой спиралью от электрической плиты. Вызвано это тем, что водородные связи образуются не только между карбонильной группой и аминогруппой, но и между этими группами и молекулами воды. При этом некоторые из этих групп разворачиваются в ту сторону, где их «ждут» молекулы воды. В результате такой пространственной ориентации некоторые участки спирали вынуждены сближаться, спираль при этом изгибается и возникает клубок. Это — третичная структура. Белки, молекулы которых состоят из одной полипептидной цепи, имеют только первичную, вторичную и третичную структуры. Если же в состав молекулы белка входят две или более полипептидных цепей, то образуется четвертичная структура.
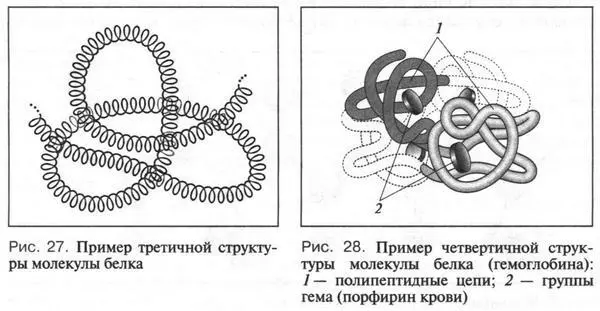
Четвертичная структура — это объединение нескольких полипептидных цепей в единый, очень сложный комплекс. Он определяет все свойства белка. Четвертичную структуру имеет, например, гемоглобин (рис. 28). В состав его молекулы входят четыре полипептидные цепи. С каждой цепью связана одна особая группа — гем , к которой присоединяется молекула кислорода.
В настоящее время ученые многих стран ведут интенсивные исследования белков, в том числе ферментов и гормонов. Все эти работы направлены к одной цели — химическому синтезу белка. Синтез белка — труднейшая задача, и для ее решения нужно ответить на многие сложные вопросы. Первый из них — установление строения белковых молекул, расшифровка их структуры. Если этот вопрос решить, то можно подойти и к решению второго вопроса: к синтезу более простых веществ, но построенных по тому же типу, что и белки. Такими веществами являются, например, полипептиды.
Как же химики и биологи устанавливают аминокислотный состав белков? Для этого они используют чаще всего метод гидролиза, который, как известно, состоит в том, что на белок действуют или ферментами, или кипятят его в растворе соляной кислоты несколько часов. При этом белок распадается на отдельные аминокислоты.
Но знать, из каких аминокислот построен белок, — это одно, а расшифровать, в какой последовательности эти аминокислоты соединены между собой в полипептидной цепи, — совсем другое!
С этой целью приходится проводить гидролиз постепенно, последовательно отщепляя одну молекулу аминокислоты за другой, определяя при этом и их строение. Можете представить, какая это сложная и кропотливая работа!
В 1954 г. была одержана первая большая победа — расшифрована структура белка инсулина, регулирующего сахарный обмен в организме. Чтобы установить формулу этого гормона, английскому биохимику Фредерику Сенгеру потребовалось 10 лет. Формула молекулы этого белка — C 254H 377O 75N 65S 6. Оказалось, что эта молекула состоит из двух полипептидных цепей. В состав одной из них входит 21 аминокислотный остаток, а в состав второй — 30. Эти полипептидные цепи связаны друг с другом S—S-связями. За расшифровку строения белков, в том числе и инсулина, в 1958 г. Ф. Сенгер был удостоен Нобелевской премии. Почему же ученый выбрал инсулин, а не другой белок? Во-первых, потому, что, как ему показалось, изучив строение этого гормона, можно будет понять, почему он так активен, чем вызвана его способность автоматически регулировать содержание сахара в крови. Во-вторых, что не менее важно, этот белок удалось получить в чистом виде. Это очень важно для опытов. В-третьих, молекула инсулина не так уж и сложна. Среди других белков, сложнейших по структуре, молекула этого гормона — просто «карлик» (хотя этот «карлик» содержит 777 атомов!). Однако, несмотря на кажущуюся простоту этого белка, на расшифровку каждой полипептидной цепи Ф. Сенгер потратил по одному году. Еще восемь лет ушло на решение других вопросов, связанных с установлением места расположения мостиков, соединяющих обе цепи, как закручены и как уложены полипептидные цепи и т. д. Вот как трудно решалась проблема с установлением строения этого важного для человека гормона. Однако работа Ф. Сенгера имела и другое значение — она наметила основные пути синтеза этого гормона. В результате в 1960-1970 гг. синтез инсулина был осуществлен коллективами ученых США, ФРГ и СССР.
Работа ученых по расшифровке и синтезу белков продолжалась. Так, в 1966 г. был синтезирован гормон секретин, который стимулирует выделение поджелудочной железой воды и бикарбонатов. Этот полипептид содержит 27 аминокислотных остатков. Через два года был осуществлен синтез еще более сложного белка — рибонуклеазы, состоящей из 124 остатков аминокислот. Однако и это уже не предел. За последние десятилетия в изучении первичной структуры белков и их синтеза достигнут значительный прогресс. Ежегодно устанавливают полную структуру около 100 новых белков. При этом расшифровываются довольно сложные белки — ферменты. Например, в 1980 г. было расшифровано строение сложнейших ферментов — производных нуклеиновых кислот, полипептидные цепи которых состоят из 1342 и 1407 аминокислотных остатков! Через год был синтезирован полипептид, содержащий 41 остаток аминокислоты. Уже сегодня известны первичные структуры более 2 тыс. белков. Это стало возможным с появлением в биохимии новых методов исследования, современных приборов, широкого использования ЭВМ. Так, с привлечением компьютерной техники была получена информация о пространственной структуре некоторых белков, молекулы которых содержат многие тысячи атомов. А совсем недавняя победа ученых просто потрясает воображение: получена полная картина строения генома человека!
Читать дальшеИнтервал:
Закладка:









