Николай Друзьяк - Как продлить быстротечную жизнь
- Название:Как продлить быстротечную жизнь
- Автор:
- Жанр:
- Издательство:Издательство «Крылов»
- Год:2009
- Город:СПб.
- ISBN:978-5-9717-0531-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Друзьяк - Как продлить быстротечную жизнь краткое содержание
Автор книги «Как продлить быстротечную жизнь» академик Одесской региональной академии наук Николай Друзьяк поставил перед собой задачу – добиться того, чтобы человеческая жизнь стала длинной и без болезней. Он внес существенный вклад в решение этой проблемы.
До сего времени мы знали, что на ухудшение здоровья влияют загрязненная среда, в которой мы проживаем (вода, воздух, отравленная пища с добавлением вредных трансжиров, нитратов), снижение активности иммунной системы, курение и т. д.
Но, как выяснил Николай Друзьяк, главную роль в возникновении заболеваний играет ощелачивание крови. Именно оно приводит к развитию разнообразных болезней.
Какие же из заболеваний излечиваются по методу академика Н.Г. Друзьяка?
Фактически все.
И это сенсация!
Как продлить быстротечную жизнь - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Атомы активных элементов, не имеющие набора электронов, свойственных инертным газам, стремятся достичь устойчивости инертных газов, либо приобретая новые электроны, либо освобождаясь от лишних. В качестве примера опять рассмотрим хлорид натрия. Третий период в периодической таблице элементов начинается с натрия и кончается инертным газом аргоном. У натрия полностью заполнены первая и вторая оболочки (2 и 8), а на третьей находится только один электрон. Поэтому натрий легко отдает этот один электрон на внешней оболочке и приобретает устойчивость инертного газа неона. А хлор тоже находится в третьем периоде, но у него на третьей оболочке находится не один, как у натрия, а 7 электронов, поэтому ему более свойственно не сбросить эти 7 электронов, а присоединить всего лишь один и таким образом приобрести устойчивость инертного газа аргона (2, 8 и 8 электронов). Так и образуется хлорид натрия – натрий отдает один электрон и становится ионом со знаком плюс (+), а хлор присоединяет один электрон и становится ионом со знаком минус (-). И в результате ионного взаимодействия между этими ионами получается устойчивая молекула поваренной соли.
Теперь посмотрим с этой же позиции (с позиции устойчивости атома) на атомы водорода и кислорода. Водород находится в первом периоде периодической таблицы и имеет всего один электрон. А второй элемент этого периода – гелий – имеет два электрона (то есть первая оболочка у него полностью заполнена), и в результате – это химически инертный газ. А водород – химически активный газ. Он не может стать похожим на гелий путем присоединения второго электрона (отрицательного иона водорода никто еще не обнаруживал), так как у него мал заряд. Но для этого (чтобы стать подобным гелию) у него имеется другой путь (об этом чуть ниже).
Второй период таблицы Менделеева заканчивается инертным газом неоном, у которого полностью заполнены электронами первая и вторая оболочки (2 и 8). В этом же периоде находится и кислород, которому недостает двух электронов для полного заполнения второй оболочки, чтобы стать устойчивым, подобно неону. Поэтому кислород и является сильным окислителем – он всегда стремится присоединить на свою вторую оболочку еще два электрона (окислителем называется то вещество, которое в ходе реакции принимает электроны). И если в какой-то момент к атому кислорода приблизится атом водорода (при высокой температуре), может произойти обобщение электронов атомов кислорода и водорода, то есть электрон, принадлежащий водороду, может начать двигаться по орбите и вокруг ядра атома водорода, и вокруг ядра атома кислорода. Одновременно и точно так же один электрон, принадлежащий кислороду, тоже начнет вращаться вокруг ядер и кислорода, и водорода, обеспечивая связь между этими ядрами. Такая связь, образованная парой электронов, находящихся в общем «пользовании» у двух атомов, называется ковалентной связью (приставка «ко» в слове «ковалентная» обозначает совместное участие и соответствует приставке «со» в русских словах, как, например, в словах «сотрудник», «соавтор», в итоге слово «ковалентная» означает «объединенная»). Ковалентная связь настолько широко распространена среди химических веществ, что иногда ее просто называют химической связью. Здесь же следует отметить, что в данном случае для нас наиболее важным положением квантово-механической теории является то, что движение электронов происходит по «разрешенным» орбитам. А понятие орбита означает пространственное описание движения электрона, соответствующее определенному устойчивому состоянию.
Продолжим рассматривать процесс образования молекулы воды. После присоединения одного атома водорода к кислороду у последнего до полного заполнения второй оболочки недостает всего одного электрона, чтобы получилась устойчивая структура по образцу инертного газа неона. Поэтому кислород присоединяет с помощью ковалентной связи еще один атом водорода, и в результате образуется молекула воды. Очень устойчивая молекула (и не так-то легко ее разрушить, поэтому долгое время – вплоть до XVIII века – вода считалась простым веществом), так как и у кислорода полностью заполнены электронами обе оболочки, и у атомов водорода первая (и единственная) оболочка тоже полностью заполнена двумя электронами. И каждый из атомов водорода в молекуле воды становится подобным атому гелия.
Так мы восстановили в своей памяти сведения об ионной и ковалентной связях, а теперь нам предстоит выяснить физическую сущность еще одной связи – водородной.
Вокруг ядра атома кислорода в молекуле воды на второй оболочке вращаются восемь электронов. Но, согласно той же квантовой механике, все эти электроны не создают какую-то общую сферу, а вращаются только попарно по четырем обособленным орбитам или орбиталям. По двум орбитам вращаются две пары электронов, которые взаимодействуют только с ядром кислорода (так называемые неподеленные пары электронов). А по двум другим орбитам также движутся по два электрона, «обслуживающие» уже и атом водорода, и атом кислорода, и находящиеся, таким образом, уже в «совместном пользовании», которые и создают ковалентную связь между двумя атомами водорода и атомом кислорода. Электронные пары, образующие ковалентную связь, смещены к ядру кислорода и немного удалены от ядер водорода. Это ведет к тому, что оба атома водорода приобретают некоторый положительный заряд. Эти же электронные пары оказывают влияние и на орбиты неподеленных пар электронов, принуждая их несимметрично удлиняться, что создает повышенную плотность электронного облака на удаленном от ядра кислорода участке орбиты, а это равноценно некоему отрицательному заряду в этом месте (см. рис. 4).
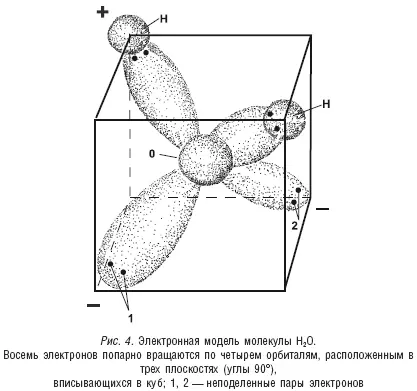
В итоге молекулу воды можно рассматривать как треугольную пирамиду тетраэдрического типа, в вершинах которой размещаются четыре заряда: два положительных и два отрицательных (см. рис. 5).
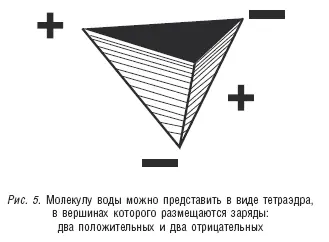
Такое распределение зарядов превращает молекулу воды в диполь. Кроме того, положительный заряд слабо экранированного ядра атома водорода притягивает отрицательный заряд электроотрицательного атома кислорода второй молекулы воды. Это притяжение примерно в 20 раз слабее, чем ковалентная связь, которая удерживает атом водорода около атома кислорода в первой молекуле воды, однако это достаточно сильное взаимодействие между двумя молекулами воды (структура льда построена только на таких связях, но об этом будет сказано ниже). Атом водорода в данном случае служит мостиком между двумя атомами кислорода, причем с одним из них он связан ковалентной связью, а с другим – электростатическими силами взаимодействия. Такая связь называется водородной. И если ковалентные связи мы изображаем прямыми линиями, то водородные – точечными, подчеркивая этим, что они гораздо слабее первых.
Читать дальшеИнтервал:
Закладка:










