Николай Друзьяк - Как продлить быстротечную жизнь
- Название:Как продлить быстротечную жизнь
- Автор:
- Жанр:
- Издательство:Издательство «Крылов»
- Год:2009
- Город:СПб.
- ISBN:978-5-9717-0531-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Друзьяк - Как продлить быстротечную жизнь краткое содержание
Автор книги «Как продлить быстротечную жизнь» академик Одесской региональной академии наук Николай Друзьяк поставил перед собой задачу – добиться того, чтобы человеческая жизнь стала длинной и без болезней. Он внес существенный вклад в решение этой проблемы.
До сего времени мы знали, что на ухудшение здоровья влияют загрязненная среда, в которой мы проживаем (вода, воздух, отравленная пища с добавлением вредных трансжиров, нитратов), снижение активности иммунной системы, курение и т. д.
Но, как выяснил Николай Друзьяк, главную роль в возникновении заболеваний играет ощелачивание крови. Именно оно приводит к развитию разнообразных болезней.
Какие же из заболеваний излечиваются по методу академика Н.Г. Друзьяка?
Фактически все.
И это сенсация!
Как продлить быстротечную жизнь - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Так изображается водородная связь между двумя молекулами воды:
Н – О – Н ··· О <
Молекула воды может иметь четыре водородные связи, но между двумя атомами кислорода всегда находится только один атом водорода.
Жидкости, молекулы которых удерживаются вместе водородными связями, называют ассоциированными (объединенными) жидкостями. К таким жидкостям относится и вода. Водородные связи обусловливают необычайную силу сцепления воды, проявляющуюся и в ее высоком поверхностном натяжении. Высокая температура кипения воды также обусловлена большой энергией, необходимой для разрушения (или для разрыва) водородных связей. Поскольку все эти свойства воды имеют в буквальном смысле слова жизненное значение для растений и животных и поскольку эти свойства зависят от водородных связей, то эти связи можно смело назвать жизненными связями в таком же смысле, как ковалентные связи часто называют просто химическими связями.
Водородные связи образуются лишь с немногими элементами периодической таблицы – с кислородом, фтором, азотом и изредка с хлором. И объясняется это большой разностью между электроотрицательностью водорода и электроотрицательностями указанных выше элементов. Электроотрицательность водорода равна 2,2, что намного меньше электроотрицательности азота (3,0), кислорода (3,4) или фтора (4,0). По этой причине связь между водородом и любым из этих трех элементов обладает довольно высокой полярностью, причем атом водорода всегда находится на положительном конце диполя.
Что это за понятие – электроотрицательность? Электронные пары, обобществляемые двумя различными атомами, не обязательно распределяются между ними поровну, что и было уже показано на молекуле воды. Если один из атомов сильнее притягивает обобществляемые электроны, чем другой, между ними возникает полярная ковалентная связь. Способность атома притягивать к себе электроны, обобществляемые при образовании химической связи, называется его электроотрицательностью.
Водородные связи почти в 20 раз слабее ковалентных, но во много раз сильнее ван-дер-ваальсовых. Впрочем, об этих связях можно говорить и как в меру сильных, и как в меру слабых. Например, на одних только водородных связях построена кристаллическая решетка льда. Все мы знаем, насколько прочен лед. Но стоит немного нагреть лед, как он начнет таять, так как при этом начнут разрушаться водородные связи. Образование льда – это самое наглядное проявление водородных связей. Но эти связи играют чрезвычайно важную роль и в существовании всего живого, они имеются в крови, в белках, в нуклеиновых кислотах и во многих других биополимерах. Например, упорядоченность строения белков не может быть достигнута без участия водородных связей. Белки бывают скручены в спирали, и такую спиралевидную форму обеспечивают водородные связи. В результате нагревания белков (при варке) водородные связи разрываются, и скрученная цепь необратимо теряет свою форму. Водородные связи оказывают влияние и на вязкость крови. При кислой крови величина водородных связей между молекулами воды уменьшается, и кровь (а это в основе своей – вода) становится менее вязкой и, следовательно, более текучей, она легче проникает в микрокапилляры. Такая кровь лучше снабжает клетки нашего организма кислородом. И в быту мы имеем дело с водородными связями; например, при каждой стирке мы пытаемся уменьшить их с помощью поверхностноактивных веществ.
Но самое главное в действиях водородных связей заключается в том, что только благодаря им вода может находиться в жидком состоянии, а следовательно, что возможна сама жизнь. Не вдаваясь в подробности, кратко скажу, что вода имеет столь высокую температуру кипения (100 °C) только потому, что водородные связи удерживают ее молекулы в компактном состоянии (в жидком состоянии). И если бы не было этих связей, любая молекула воды, имея лишь незначительную тепловую энергию, могла бы испариться, и мы имели бы это вещество только в газообразном состоянии.
Но все это пока что всего лишь интересная информация о водородных связях. А теперь мы рассмотрим те явления, связанные с водородными связями, которые непосредственно оказывают влияние на наше здоровье и которыми мы можем хотя бы в некоторой мере управлять.
Поверхностное натяжение воды
Водородные связи определяют и величину поверхностного натяжения воды, а поэтому по величине этого натяжения мы можем судить, хотя и косвенно, и о величине водородных связей в той же воде. Измеряется же поверхностное натяжение легко и просто. Поэтому в дальнейшем, когда речь будет идти о величине поверхностного натяжения, мы можем считать, что речь идет и о величине водородных связей. А, уменьшая величину водородных связей, мы будем уменьшать величину вязкости то ли воды, то ли крови. Последнее нас больше всего и интересует. Изменять величину водородных связей можно разными способами. Одним из таких способов является температурный режим жидкости. Чем выше температура воды, тем меньше величина водородных связей в воде, и тем меньше поверхностное натяжение воды, и тем меньше вязкость воды.
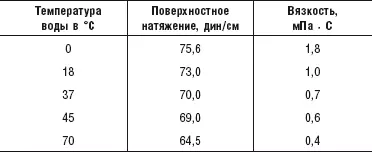
В таблице 4 показано, как зависит поверхностное натяжение и вязкость воды от ее температуры. При повышении температуры воды увеличивается число разорванных водородных связей (в связи с увеличением тепловой энергии молекул воды), а поэтому уменьшаются и поверхностное натяжение воды, и ее вязкость. Но так как повысить температуру тела (и температуру крови) выше 37 °C мы не можем, то ясно, что с помощью температурного фактора мы никак не сможем воздействовать на вязкость крови. Поэтому люди и вынуждены разжижать кровь при помощи всевозможных кислот.
Из таблицы 4 видно, что поверхностное натяжение воды величиной в 69 единиц мы можем получить с помощью нагрева ее до 45 °C, имея при этом определенную величину вязкости. Но точно такой же показатель по вязкости мы можем получить и без нагрева воды, понижая ее поверхностное натяжение до 69 единиц каким-либо иным способом. Например, добавлением в воду этилового спирта. Водка (40 % этилового спирта и 60 % воды) имеет поверхностное натяжение в 30 единиц. Кстати, именно по этой причине она легко и быстро проникает в кровь. Но если нам нужна не водка, а питьевая вода с пониженным поверхностным натяжением, то мы можем добавить в воду лишь незначительное количество этилового спирта (до 2 % – такое количество этого спирта содержит кумыс, речь о котором будет идти в 7-й главе) и получим воду с поверхностным натяжением около 69 единиц. То есть без нагрева воды до 45 °C мы получаем такую же вязкость, как и при этой температуре.
Читать дальшеИнтервал:
Закладка:










