БСЭ - Большая Советская энциклопедия (ВА)
- Название:Большая Советская энциклопедия (ВА)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ - Большая Советская энциклопедия (ВА) краткое содержание
Большая Советская энциклопедия (ВА) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
В комплексных соединениях координационное число центрального атома часто больше числа электронов в его валентной оболочке. Важную роль здесь играют донорно-акцепторная связь и дативные связи, образующиеся за счёт неподелённой электронной пары (то есть пары электронов с противоположными спинами, занимающих одну АО) одного атома и пустой орбитали другого. Соответственно должны быть расширены и представления о В.: способность к образованию связей, а следовательно и В. атома, обусловливается не только неспаренными электронами, но и неподелёнными парами и пустыми орбиталями валентной оболочки. Наибольшая суммарная В. должна быть равна числу всех АО, составляющих валентную оболочку атома, поскольку каждая валентная АО, независимо от того, сколькими электронами она заселена у атома в валентном состоянии, потенциально способна образовать одну связь (гайтлер-лондоновскую, донорно-акцепторную или дативную). В рамках этой концепции максимальная В. всех элементов второго периода от Li до F равна 4 (одна s -opбиталь + три р -орбитали), у элементов следующих периодов — 9 (за счёт ещё пяти d -opбиталей) и т.д. Решение же вопроса о том, какие из этих четырёх или девяти В. насыщаются и какие остаются неиспользованными, в соединениях каждого конкретного типа определяется не только свойствами самого атома и его положением в периодической системе, но и особенностями соединения в целом. Полный ответ на него может быть получен с помощью квантово-химических расчётов. За счёт донорно-акцепторного взаимодействия фактическое число связей атома (а следовательно и его В.) в комплексных и даже в простых соединениях в общем случае может быть больше не только числа его неспаренных электронов, но и числа связанных с ним соседних атомов.
Следует помнить, что подразделение связей в соединениях на гайтлер-лондоновские, донорно-акцепторные и дативные имеет, вообще говоря, лишь генетический смысл, поскольку после того как соединение образуется, в нём происходит перераспределение электронной плотности и выравнивание связей: например, в каждом из комплексных анионов типа [BF 4] -, [BeF 4] 2-, [SiFe6] 2-, [АlF6] 3-, [ZnF 6] 4-и др. все связи М — F совершенно одинаковы.
Установлено также, что в солях ион NO 3 -имеет структуру правильного треугольника, а ионы 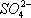 и
и 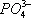 — структуру правильного тетраэдра. Поэтому строение молекул соответствующих солей точнее описывается приведёнными на рис. 5структурными формулами г — е , а не традиционными формулами а — в ,которые не учитывают реальной структуры ионов.
— структуру правильного тетраэдра. Поэтому строение молекул соответствующих солей точнее описывается приведёнными на рис. 5структурными формулами г — е , а не традиционными формулами а — в ,которые не учитывают реальной структуры ионов.
Теория локализованных пар ограничена в основном несопряжёнными органическими и простыми неорганическими соединениями. Так, в случае «электронно-избыточных» молекул типа PF 5, SF 6, IF 7, XeF 6эта теория не может объяснить осуществления высших В. у атомов Р, S, I, Xe без привлечения валентных состояний с большими целочисленными заселённостями внешних d -opбиталей ( sp 3 d для Р, sp 3 d 3для I, s 2 p 3 d 3для Xe и т.д.); однако энергии возбуждения последних столь велики (200—400 ккал/моль и более), что затраты на их возбуждение вряд ли могут окупиться за счёт выигрыша в энергии при образовании связей. Аналогичные трудности возникают при рассмотрении комплексных соединений, координационных кристаллов и т.д. В «электронно-дефицитных» молекулах типа В 2Н 6( рис. 1 , в) число связей, образуемых атомом Н, больше числа имеющихся у него валентных АО, так что связи мостиковых Н с двумя атомами В могут быть описаны только трёхцентровыми молекулярными орбиталями, охватывающими фрагменты В — Н — В. В случае ароматических и сопряжённых молекул типа C 5H 5, C 6H 6, C 7H 7и др., их комплексов с металлами ( рис. 3 ) и других производных валентные 2 р p-электроны в равной степени принадлежат всем атомам С и могут быть описаны лишь с помощью делокализованных молекулярных орбиталей, охватывающих всё кольцо или углеродный остов в целом. Иными словами, представления о локализованных В. и связях оказались слишком узкими, чтобы вместить все известные типы соединений.
Поэтому естественным следующим шагом в развитии общей теории В. стал метод молекулярных орбиталей, MO, который рассматривает молекулу как совокупность ядер и электронов, где каждый электрон движется в поле остальных электронов и всех ядер. Молекулярные орбитали, описывающие состояние электронов, в общем случае охватывают все атомы молекулы, так что каждый атом способен в принципе образовывать связи со всеми остальными атомами молекулы. Метод МО значительно более общ и последователен, что делает его в принципе пригодным для описания любых классов соединений. (См. Молекулярных орбиталей метод , Химическая связь .)
Лит.: Сыркин Я. К., Периодическая система и проблема валентности, М., 1971; Сыркин Я. К. и Дяткина М. Е., Химическая связь и строение молекул, М.—Л., 1946; Паулинг Л., Природа химической связи, пер. с англ., М. — Л., 1947; Шусторович Е. М., Новое в учении о валентности, М., 1968; Коулсон Ч., Валентность, пер. с англ., М., 1965: Маррел Д., Кеттл С., Теддер Д., Теория валентности, пер. с англ., М., 1968; Астахов К. В., Современное состояние периодической системы Д. И. Менделеева, М., 1969.
О. П. Чаркин.
Под редакцией академика Я. К. Сыркина.
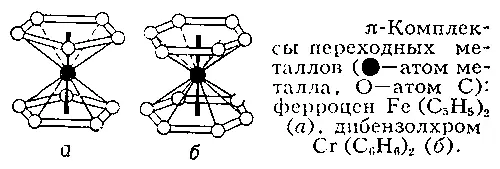
Рис. 3. (p-Комплексы переходных металлов (  — атом металла,
— атом металла,  — атом С): ферроцен Fe(C 5H 5) 2(а), дибензолхром Cr(C 6H 6) 2(б).
— атом С): ферроцен Fe(C 5H 5) 2(а), дибензолхром Cr(C 6H 6) 2(б).
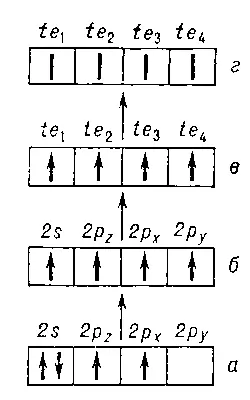
Рис. 4. Схема возбуждения валентного состояния (г) атома углерода в молекуле типа CH 4из основного состояния (а): а — основное состояние наинизшей конфигурации 2s 22p 2; б — нижнее состояние валентной конфигурации 2s2p 3; в— гибридизация АО; г—неопределённая ориентация спинов валентных электронов (валентное состояние).
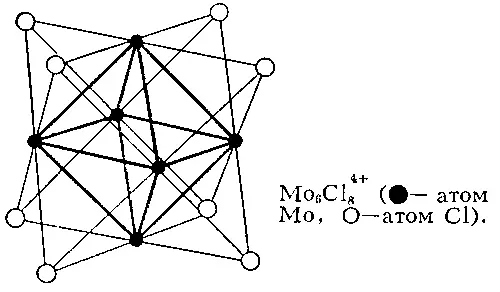
Рис. 2. Кластерная структура Mo 6Cl 4+ 8(  — атом Mo,
— атом Mo,  — атом Cl).
— атом Cl).
Интервал:
Закладка:










