БСЭ БСЭ - Большая Советская Энциклопедия (ИО)
- Название:Большая Советская Энциклопедия (ИО)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ИО) краткое содержание
Большая Советская Энциклопедия (ИО) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Иодиды природные
Иоди'ды приро'дные,группа минералов солей иодистоводородной кислоты, очень редко встречающихся вместе с другими минералами в зоне окисления месторождений серебра, меди и др. цветных металлов. Известны: майерсит (Ag, Cu)I, купроиодаргирит (Си, Ag)I (кристаллизуется в кубической системе, структура типа сфалерита ); иодаргирит AgI (гексагональная система, структура типа вюрцита); маршит CuI, для которого известны как кубическая (структура типа сфалерита), так и гексагональная модификации. Цвет минералов жёлтый, различных оттенков; просвечивают или прозрачны; блеск смолистый до алмазного. Твёрдость по минералогической шкале 2,5 (у иодаргирита 1—1,5); плотность (в кг / м 3) от 5504 (иодаргирит) до 5640 (майерсит). Находятся в виде отдельных кристалликов, пластинчатых и чешуйчатых агрегатов, а также образуют сплошные массы. Большинство И. п. известно в окисленных рудах месторождений Чили, Мексики, США, Австралии и др.; в СССР иодаргирит обнаружен в Казахстане и Забайкалье.
Лит.: Минералы. Справочник, т. 2, в. 1, М., 1963.
Иодистоводородная кислота
Иодистоводоро'дная, кислота',раствор иодистого водорода в воде.
Иодистый водород
Ио'дистый водоро'д,HI, соединение иода с водородом; бесцветный газ с резким запахом; во влажном воздухе сильно дымит, притягивая влагу и образуя мельчайшие капельки иодистоводородной кислоты; t пл— 50,9 °С, t кип— 35,9 °C. И. в. — нестойкое соединение, при повышении температуры диссоциирует 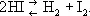 Хорошо растворяется в воде. Получается при взаимодействии паров иода с водородом над катализатором при температуре около 500 °С.
Хорошо растворяется в воде. Получается при взаимодействии паров иода с водородом над катализатором при температуре около 500 °С.
Водный раствор И. в. (иодистоводородная кислота) — сильная кислота; бесцветная жидкость с резким запахом, постепенно желтеющая на свету (из-за выделения иода в результате окисления кислородом воздуха). Кислота, поступающая в продажу, содержит около 45% HI и имеет плотность 1,5 г / см 3, применяется для получения иодидов.
Иодная кислота
Ио'дная кислота',HIO 4, слабая неорганическая кислота. Образует с водой несколько соединений общей формулы (HIO 4) n ×(H 2O) m , в которых атомы водорода могут полностью или частично замещаться металлами. Такие соединения рассматриваются как сложные многоосновные кислоты состава H 3IO 5, H 4I 2O 9, H 5IO 6. Соли И. к. (периодаты) стойки и разлагаются только при нагревании до 250—300 °С; сильные окислители. Получаются при окислении иодатов в щелочной среде хлором, например NaIO 3+ 6NaOH + Cl 2= Na 2IO 6+ 2NaCl + 3H 2O. Применяются как химические реактивы.
Иодная лампа
Ио'дная ла'мпа, лампа накаливания , содержащая в составе наполняющей газовой смеси, кроме инертного газа, галогены (обычно иод или бром) и работающая с использованием галогенного цикла — процесса обратного переноса на тело накала вольфрама, испаряющегося с него. Благодаря образованию при температуре выше 300—400 °С газообразных соединений вольфрама с галогенами и их распаду вблизи поверхности тела накала исключается оседание на стенках колбы частиц вольфрама. Это позволяет резко сократить размеры колбы-лампы без опасения большого снижения светового потока в течение срока службы. Колба выполняется из тугоплавкого кварцевого стекла . Нагрев колбы в процессе эксплуатации до 600—700 °С обеспечивает высокое давление наполняющего газа во время горения. И. л. при одинаковых с обычной лампой накаливания мощности и сроке службы имеют меньшие размеры и значительно более высокую световую отдачу. И. л. находят широкое применение в различных оптических системах, световых приборах и т. п.
Лит. см. при ст. Лампа накаливания .
В. М. Скобелев.
Иодноватая кислота
Иоднова'тая кислота',HIO 3, сильная неорганическая кислота. В свободном состоянии И. к. — кристаллическое вещество, t пл110 °С; хорошо растворима в воде. При нагревании около 200 °С теряет воду, превращаясь в ангидрид I 2O 5. Получают И. к. по реакции: 3I 2+ 10HNO 3= 6HIO 3+ 10NO + 2H 2O (при 70—80 °С). Соли её (иодаты) разлагаются при нагревании до 400 °С; сильные окислители. При взаимодействии с иодидами в присутствии кислот выделяют иод: KIO 3+ 5KI + 3H 2SO 4= 3I 2+ 3K 2SO 4+ + 3H 2O. Иодаты получаются при взаимодействии иода с горячими растворами едких щелочей или при окислении иодидов; применяются как химические реактивы.
Иодноватистая кислота
Иоднова'тистая кислота',HIO, слабая неорганическая кислота. Существует только в разбавленных водных растворах. Может диссоциировать и как кислота ( 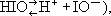 и как основание (
и как основание ( 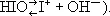 Соли её (гипоиодиты) также нестойки и известны только в растворах; получаются при действии иода на растворы щелочей на холоду.
Соли её (гипоиодиты) также нестойки и известны только в растворах; получаются при действии иода на растворы щелочей на холоду.
Иодное число
Ио'дное число',масса иода (в г ), присоединяющегося к 100 г органического вещества. И. ч., которое характеризует содержание двойных связей в ненасыщенном соединении, определяют при исследовании жиров (см. Жиры животные ), а также при анализе жирных кислот (см. Карбоновые кислоты ) и установлении содержания реагирующих с иодом примесей в ароматических углеводородах. В некоторых случаях при определении И. ч. устанавливают массу более легко присоединяющегося брома и вычисляют эквивалентную ей массу иода.
Иодометрия
Иодоме'трия,метод титриметрического анализа веществ, которые обладают окислительными или восстановительными свойствами, основанный на использовании обратимой реакции: 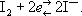 Систему I 2/2I —, нормальный потенциал которой равен + 0,5345 в (25 °С), используют для определения восстановителей с потенциалом меньше + 0,5345 в (например, солей двухвалентного олова, сероводорода) и окислителей с потенциалом больше + 0,5345 в (например, перекисей, хромовой и марганцовой кислот, солей двухвалентной меди и трёхвалентного железа). Рабочими растворами при титровании служат растворы иода и тиосульфата натрия , индикатором — крахмал.
Систему I 2/2I —, нормальный потенциал которой равен + 0,5345 в (25 °С), используют для определения восстановителей с потенциалом меньше + 0,5345 в (например, солей двухвалентного олова, сероводорода) и окислителей с потенциалом больше + 0,5345 в (например, перекисей, хромовой и марганцовой кислот, солей двухвалентной меди и трёхвалентного железа). Рабочими растворами при титровании служат растворы иода и тиосульфата натрия , индикатором — крахмал.
Лит.: Крешков А. П., Основы аналитической химии, 3 изд., ч. 2, М., 1971.
Иодоформ
Иодофо'рм,трийодметан (CHI 3), антисептическое средство , порошок лимонно-жёлтого цвета, применяется для лечения инфицированных ран, язв, свищей наружно в форме присыпок, мазей, на тампонах.
Иозефинизм
Иозефини'зм(Josephinismus), термин, под которым в исторической литературе понимается политика в отношении католической церкви, проводившаяся в некоторых католических государствах Европы в конце 18 в. представителями просвещённого абсолютизма , прежде всего Иосифом II в монархии Габсбургов (отсюда название). И., представлявший собой попытку реформировать католицизм, приспособив его к требованиям абсолютистского государства и потребностям начавшегося буржуазного развития, был течением, близким французскому галликанству и особенно янсенизму 17 в. Реформы в духе И. обычно включали: утверждение независимости национальной церкви от папства и полное подчинение её государственной власти, устранение влияния иезуитов, особенно в области просвещения, и утверждение светской школы, частичную секуляризацию церковных имуществ и закрытие монашеских орденов, провозглашение умеренной веротерпимости и др. Эти реформы в условиях абсолютизма и последовавшей позднее эпохи Реставрации не были осуществлены; в Австрийской империи с И. как государственной политикой было покончено с заключением конкордата 1855 с папством.
Читать дальшеИнтервал:
Закладка:
