БСЭ БСЭ - Большая Советская Энциклопедия (ИО)
- Название:Большая Советская Энциклопедия (ИО)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ИО) краткое содержание
Большая Советская Энциклопедия (ИО) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Соч.: За мастерство в живописи. Сб., М., 1952.
Лит.: Б. В. Иогансон (Каталог выставки), М., 1969; [Соколова Н.], Б. В. Иогансон, [Л., 1969].

Б. В. Иогансон.
Иогихес Лео
Иоги'хес(Jogiches) Лео (1867—1919), деятель польского и немецкого рабочего движения; см. Тышка Ян.
Иод
Ио'д(лат. Iodum), I, химический элемент VII группы периодической системы Менделеева, относится к галогенам (в литературе встречается также символ J); атомный номер 53, атомная масса 126,9045; кристаллы черно-серого цвета с металлическим блеском. Природный И. состоит из одного стабильного изотопа с массовым числом 127. И. открыл в 1811 французский химик Б. Куртуа. Нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой, он наблюдал выделение фиолетового пара (отсюда назв. И. — от греч. iódes, ioeidés — похожий цветом на фиалку, фиолетовый), который конденсировался в виде тёмных блестящих пластинчатых кристаллов. В 1813—1814 французский химик Ж. Л. Гей-Люссак и английский химик Г. Дэви доказали элементарную природу И.
Распространение в природе. Среднее содержание И. в земной коре 4×10 -5% по массе. В мантии и магмах и в образовавшихся из них породах (гранитах, базальтах и др.) соединения И. рассеяны; глубинные минералы И. неизвестны. История И. в земной коре тесно связана с живым веществом и биогенной миграцией. В биосфере наблюдаются процессы его концентрации, особенно морскими организмами (водорослями, губками и др.). Известны 8 гипергенных минералов И., образующихся в биосфере, однако они очень редки. Основным резервуаром И. для биосферы служит Мировой океан (в 1 л в среднем содержится 5×10 -5 г И.). Из океана соединения И., растворённые в каплях морской воды, попадают в атмосферу и переносятся ветрами на континенты. (Местности, удалённые от океана или отгороженные от морских ветров горами, обеднены И.) И. легко адсорбируется органическими веществами почв и морских илов. При уплотнении этих илов и образовании осадочных горных пород происходит десо'рбция, часть соединений И. переходит в подземные воды. Так образуются используемые для добычи И. иодо-бромные воды, особенно характерные для районов нефтяных месторождений (местами 1 л этих вод содержит свыше 100 мг И.).
Физические и химические свойства. Плотность И. 4,94 г / см 3, t пл113,5 °С, t кип184,35 °C. Молекула жидкого и газообразного И. состоит из двух атомов (I 2). Заметная диссоциация
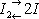
наблюдается выше 700°С, а также при действии света. Уже при обычной температуре И. испаряется, образуя резко пахнущий фиолетовый пар. При слабом нагревании И. возгоняется, оседая в виде блестящих тонких пластинок; этот процесс служит для очистки И. в лабораториях и в промышленности. И. плохо растворим в воде (0,33 г / л при 25 °С), хорошо — в сероуглероде и органических растворителях (бензоле, спирте и др.), а также в водных растворах иодидов.
Конфигурация внешних электронов атома И. 5 2 s5 5 p. В соответствии с этим И. проявляет в соединениях переменную валентность (степень окисления): — 1 (в HI, KI, см. Иодистый водород , Иодиды ), + 1 (в HIO, KIO, см. Иодноватистая кислота ), + 3 (в ICl 3, см. Межгалогенные соединения ), + 5 (в HIO 3, KIO 3, см. Иодноватая кислота ) и + 7 (в HIO 4, KIO 4, см. Иодная кислота ). Химически И. довольно активен, хотя и в меньшей степени, чем хлор и бром . С металлами И. при лёгком нагревании энергично взаимодействует, образуя иодиды (Hg + I 2= HgI 2). С водородом И. реагирует только при нагревании и не полностью, образуя иодистый водород. С углеродом, азотом, кислородом И. непосредственно не соединяется. Элементарный И. — окислитель, менее сильный, чем хлор и бром. Сероводород H 2S, тиосульфат натрия Na 2S 2O 3и др. восстановители восстанавливают его до I —(I 2+ H 2S = S + 2HI). Хлор и другие сильные окислители в водных растворах переводят его в IO 3 —(5Cl 2+ I 2+ 6H 2O = 2HIO 3+ 10HCl). При растворении в воде И. частично реагирует с ней
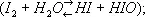
в горячих водных растворах щелочей образуются иодид и иодат (3I 2+ 6NaOH = 5NaI + NaIO 3+ 3H 2O). Адсорбируясь на крахмале, И. окрашивает его в тёмно-синий цвет; это используется в иодометрии и качественном анализе для обнаружения И.
Пары И. ядовиты и раздражают слизистые оболочки. На кожу И. оказывает прижигающее и обеззараживающее действие. Пятна от И. смывают растворами соды или тиосульфата натрия.
Получение и применение. Сырьём для промышленного получения И. в СССР служат нефтяные буровые воды; за рубежом — морские водоросли, а также маточные растворы чилийской (натриевой) селитры, содержащие до 0,4% И. в виде иодата натрия. Для извлечения И. из нефтяных вод (содержащих обычно 20—40 мг / л И. в виде иодилов) на них сначала действуют хлором (2NaI + Cl 2= 2NaCl + I 2) или азотистой кислотой (2NaI + 2NaNO 2+ 2H 2SO 4= 2Na 2SO 4+ 2NO + I 2+ 2H 2O). Выделившийся И. либо адсорбируют активным углём, либо выдувают воздухом. На И., адсорбированный углём, действуют едкой щёлочью или сульфитом натрия (I 2+ Na 2SO 3+ H 2O = Na 2SO 4+ 2HI). Из продуктов реакции свободный И. выделяют действием хлора или серной кислоты и окислителя, например дихромата калия (K 2Cr 2O 7+ 7H 2SO 4+ 6NaI = K 2SO 4+ 3Na 2SO 4+ Cr 2(SO 4) 3+ 3I 2). При выдувании воздухом И. поглощают смесью двуокиси серы с водяным паром (2H 2O + SO 2+ I 2= = H 2SO 4+ 2HI) и затем вытесняют И. хлором (2HI + Cl 2= 2HCl + I 2). Сырой кристаллический И. очищают возгонкой.
И. и его соединения применяют главным образом в медицине и в аналитической химии (см. Иодометрия ), а также в органическом синтезе и фотографии. В промышленности применение И. пока незначительно по объёму, но весьма перспективно. Так, на термическом разложении иодидов основано получение высокочистых металлов (см. Иодидный метод ).
Лит.: Ксензенко В. И., Стасиневич Д. С., Технология брома и иода, М., 1960; Позин М. Е., Технология минеральных солей, 3 изд., Л., 1970, гл. 8; Ролстен Р. Ф., Иодидные металлы и иодиды металлов, пер. с англ., М., 1968.
Д. С. Стасиневич.
Иод в организме. И. — необходимый для животных и человека микроэлемент . В почвах и растениях таёжно-лесной нечернозёмной, сухостепной, пустынной и горных биогеохимических зон И. содержится в недостаточном количестве или не сбалансирован с некоторыми другими микроэлементами (Со, Mn, Cu); с этим связано распространение в этих зонах эндемического зоба. Среднее содержание И. в почвах около 3×10 -4%, в растениях около 2×10 -5%. В поверхностных питьевых водах И. мало (от 10 -7до 10 -9%). В приморских областях количество И. в 1 м 3воздуха может достигать 50 мкг , в континентальных и горных — составляет 1 или даже 0,2 мкг .
Читать дальшеИнтервал:
Закладка:
