БСЭ БСЭ - Большая Советская Энциклопедия (КА)
- Название:Большая Советская Энциклопедия (КА)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (КА) краткое содержание
Большая Советская Энциклопедия (КА) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Реки приносят в океан много Ca, но он не задерживается в океанической воде (ср. содержание 0,04%), а концентрируется в скелетах организмов и после их гибели осаждается на дно преимущественно в форме СаСО 3. Известковые илы широко распространены на дне всех океанов на глубинах не более 4000 м (на больших глубинах происходит растворение СаСО 3, организмы там нередко испытывают дефицит Ca).
Важную роль в миграции Ca играют подземные воды. В известняковых массивах они местами энергично выщелачивают СаСО 3, с чем связано развитие карста , образование пещер, сталактитов и сталагмитов. Помимо кальцита, в морях прошлых геологических эпох было широко распространено отложение фосфатов Ca (например, месторождения фосфоритов Каратау в Казахстане), доломита СаСО 3·MgCO 3, а в лагунах при испарении —гипса.
В ходе геологической истории росло биогенное карбонатообразование, а химическое осаждение кальцита уменьшалось. В докембрийских морях (свыше 600 млн. лет назад) не было животных с известковым скелетом; они приобрели широкое распространение начиная с кембрия (кораллы, губки и т.д.). Это связывают с высоким содержанием CO 2в атмосфере докембрия.
Физические и химические свойства. Кристаллическая решётка a-формы Ca (устойчивой при обычной температуре) гранецентрированная кубическая а = 5,56 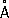 . Атомный радиус 1,97
. Атомный радиус 1,97 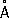 , ионный радиус Ca 2+, 1,04
, ионный радиус Ca 2+, 1,04 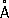 . Плотность 1,54 г/см 3 (20 °С). Выше 464 °C устойчива гексагональная b-форма. t пл851°C, t kип1482 °C; температурный коэффициент линейного расширения 22×10 -6(0—300 °C); теплопроводность при 20 °C 125,6 Вт/(м ×К) или 0,3 кал/ ( см × сек °С); удельная теплоёмкость (0—100 °С) 623,9 дж/(кг × К ) или 0,149 кал/ ( г ×°C); удельное электросопротивление при 20°C 4,6×10 -8 ом × м или 4,6×10 -6 ом × см ; температурный коэффициент электросопротивления 4,57×10 -3(20 °C). Модуль упругости 26 Гн/м 2 (2600 кгс/мм 2 ); предел прочности при растяжении 60 Мн/м 2 (6 кгс/мм 2 ); предел упругости 4 Мн/м 2 (0,4 кгс/мм 2 ), предел текучести 38 Мн/м 2 (3,8 кгс/мм 2 ); относительное удлинение 50%; твердость по Бринеллю 200—300 Мн/м 2 (20—30 кгс/мм 2 ). К. достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
. Плотность 1,54 г/см 3 (20 °С). Выше 464 °C устойчива гексагональная b-форма. t пл851°C, t kип1482 °C; температурный коэффициент линейного расширения 22×10 -6(0—300 °C); теплопроводность при 20 °C 125,6 Вт/(м ×К) или 0,3 кал/ ( см × сек °С); удельная теплоёмкость (0—100 °С) 623,9 дж/(кг × К ) или 0,149 кал/ ( г ×°C); удельное электросопротивление при 20°C 4,6×10 -8 ом × м или 4,6×10 -6 ом × см ; температурный коэффициент электросопротивления 4,57×10 -3(20 °C). Модуль упругости 26 Гн/м 2 (2600 кгс/мм 2 ); предел прочности при растяжении 60 Мн/м 2 (6 кгс/мм 2 ); предел упругости 4 Мн/м 2 (0,4 кгс/мм 2 ), предел текучести 38 Мн/м 2 (3,8 кгс/мм 2 ); относительное удлинение 50%; твердость по Бринеллю 200—300 Мн/м 2 (20—30 кгс/мм 2 ). К. достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
Конфигурация внешней электронной оболочки атома Ca 4s 2, в соответствии с чем Ca в соединениях 2-валентен. Химически Ca очень активен. При обычной температуре Ca легко взаимодействует с кислородом и влагой воздуха, поэтому его хранят в герметически закрытых сосудах или под минеральным маслом. При нагревании на воздухе или в кислороде воспламеняется, давая основной окисел CaO (см. Кальция окись ). Известны также перекиси Ca — CaO 2и СаО 4. С холодной водой Ca взаимодействует сначала быстро, затем реакция замедляется вследствие образования пленки Ca (OH) 2(см. Кальция гидроокись ). Ca энергично взаимодействует с горячей водой и кислотами, выделяя H 2(кроме концентрированной HNO 3). С фтором реагирует на холоду, а с хлором и бромом — выше 400 °С, давая соответственно CaF 2, CaCl 2и CaBr 2(см. Кальция фторид , Кальция хлорид , Кальция бромид ). Эти галогениды в расплавленном состоянии образуют с Ca так называемого субсоединения — CaF, CaCI, в которых Ca формально одновалентен. При нагревании Ca c серой получается кальция сульфид CaS, последний присоединяет серу, образуя полисульфиды (CaS 2, CaS 4и др.). Взаимодействуя с сухим водородом при 300—400 °C Ca образует гидрид CaH 2— ионное соединение, в котором водород является анионом. При 500 °C Ca и азот дают нитрид Ca 3N 2; взаимодействие Ca с аммиаком на холоду приводит к комплексному аммиакату Ca [NH 3] 6. При нагревании без доступа воздуха с графитом, кремнием или фосфором Ca дает соответственно карбид кальция CaC 2, силициды CaSi 2и фосфид Ca 3P 2. Ca образует интерметаллические соединения с Al, Ag, Au, Cu, Li, Mg, Pb, Sn и др.
Получение и применение. В промышленности Ca получают двумя способами: 1) нагреванием брикетированной смеси CaO и порошка Al при 1200 °С в вакууме 0,01—0,02 мм рт. ст .; выделяющиеся по реакции: 6CaO +2Al = 3 СаО×l 2O 3+ 3Са пары Ca конденсируются на холодной поверхности; 2) электролизом расплава CaCl 2и KCl с жидким медно-кальциевым катодом приготовляют сплав Cu — Ca (65% Ca), из которого Ca отгоняют при температуре 950—1000 °С в вакууме 0,1—0,001 мм рт. ст .
В виде чистого металла Ca применяют как восстановитель U, Th, Cr, V, Zr, Cs, Rb и некоторых редкоземельных металлов из их соединений. Его используют также для раскисления сталей, бронз и др. сплавов, для удаления серы из нефтепродуктов, для обезвоживания органических жидкостей, для очистки аргона от примеси азота и в качестве поглотителя газов в электровакуумных приборах. Большое применение в технике получили антифрикционные материалы системы Pb—Na—Ca, а также сплавы Pb—Ca, служащие для изготовления оболочки электрических кабелей. Сплав Ca—Si—Ca (силикокальций) применяется как раскислитель и дегазатор в производстве качественных сталей. О применении соединений К. см. в соответствующих статьях.
А. Я. Фишер, А. И. Перельман.
Кальций в организме. Ca — один из биогенных элементов , необходимых для нормального протекания жизненных процессов. Он присутствует во всех тканях и жидкостях животных и растений. Лишь редкие организмы могут развиваться в среде, лишённой Ca у некоторых организмов содержание Ca достигает 38%; у человека — 1,4—2%. Клетки растительных и животных организмов нуждаются в строго определённых соотношениях ионов Ca 2+, Na +и К +во внеклеточных средах. Растения получают Ca из почвы. По их отношению к Ca растения делят на кальцефилов и кальцефобов . Животные получают Ca с пищей и водой. Ca необходим для образования ряда клеточных структур, поддержания нормальной проницаемости наружных клеточных мембран, для оплодотворения яйцеклеток рыб и др. животных, активации ряда ферментов. Ионы Ca 2+передают возбуждение на мышечное волокно, вызывая его сокращение, увеличивают силу сердечных сокращений повышают фагоцитарную функцию лейкоцитов, активируют систему защитных белков крови, участвуют в её свертывании. В клетках почти весь Ca находится в виде соединений с белками, нуклеиновыми кислотами, фосфолипидами, в комплексах с неорганическими фосфатами и органическими кислотами. В плазме крови человека и высших животных только 20—40% Ca может быть связано с белками. У животных, обладающих скелетом, до 97—99% всего Ca используется в качестве строительного материала: у беспозвоночных в основном в виде CaCO 3(раковины моллюсков, кораллы), у позвоночных — в виде фосфатов. Многие беспозвоночные запасают Ca перед линькой для построения нового скелета или для обеспечения жизненных функции в неблагоприятных условиях.
Читать дальшеИнтервал:
Закладка:
