БСЭ БСЭ - Большая Советская Энциклопедия (КА)
- Название:Большая Советская Энциклопедия (КА)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (КА) краткое содержание
Большая Советская Энциклопедия (КА) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Лит.: Оптические материалы для инфракрасной техники, М., 1965; Кальцит, в кн.: Физический энциклопедический словарь, т. 2, М., 1962; К остов И., Минералогия, [пер. с англ.], М., 1971.
М. Д. Дорфман, М. О. Клия.
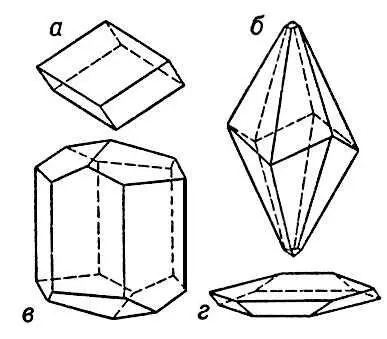
Кристаллы кальцита: а — ромбоэдрический; б — скаленоэдрический; в — призматический; г — таблитчатый.
Кальциферолы
Кальциферо'лы,витамины группы D; по химическому строению близки к стеринам . К. встречаются в виде эргокальциферола (витамина D 2) и холекальциферола (витамина D 3), образующихся соответственно из эргостерина и дегидрохолестерина в результате облучения последних ультрафиолетовыми лучами. Эргокальциферол обнаружен в очень малых количествах в растительных продуктах. Холекальциферол содержится главным образом в продуктах животного происхождения (сыр жирный, сливочное масло, яичный желток, говяжья печень, печень трески и палтуса, сельдь, лосось, тунец). К. регулируют обмен кальция и фосфора в организме. См. также Витамины .
Кальцифир
Кальцифи'р,метаморфическая горная порода, состоящая из кальцита или доломита; в подчинённом количестве присутствуют гранат, пироксен, форстерит, шпинель, полевой шпат и др. минералы. К. противопоставляется мрамору , содержащему немного примесей.
Кальция бромид
Ка'льция броми'д,бромистый кальций, CaBr 2, соль; бесцветные кристаллы, плотность 3,35 г/см 3 , t пл760 °С. Легко растворим в воде (594 г на 100 г H 2O при 0 °С). Известен кристаллогидрат CaBr 2×6H 2O, t пл38,2 °С. Получают К. б. взаимодействием брома с известковым молоком в присутствии аммиака и др. способами. Применяют для получения светочувствительных фотоматериалов.
Кальция гидроокись
Ка'льция гидроо'кись,гашёная известь, пушонка, Ca (OH) 2, сильное основание; бесцветные кристаллы, плотность 2,24 г/см 3 . Технический продукт — белый пушистый порошок. При нагревании отщепляет воду, превращаясь в CaO. Растворимость в воде очень мала ( г на 100 г H 2O): 0,165 (20 °С), 0,077 (100 °С); в присутствии солей растворимость сильно повышается. Водный раствор К. г. называют известковой водой, а суспензия К. г. в воде — известковым молоком. К. г. легко поглощает углекислый газ из воздуха:
Ca (OH) 2+ CO 2= CaCO 3+ H 2O.
Применяют К. г. как дешёвую щелочь , а также в строительстве и др. областях. См. также Известь .
Кальция карбид
Ка'льция карби'д,соединение кальция с углеродом, CaC 2; см. Карбид кальция .
Кальция карбонат
Ка'льция карбона'т,углекислый кальций, CaCO 3, соль. В природе образует два минерала, различающиеся кристаллической структурой: широко распространённый кальцит и арагонит . При нагревании выше 900 °С К. к. разлагается:
CaCO 3= CaO + CO 2
(способ получения извести ). Трудно растворим в воде (14 мг кальцита в 1 л при 18 °С), легко — в кислотах. Природный К. к. (известняк, мрамор) применяют как строительный материал; мел (молотый К. к.) — наполнитель для резиновых смесей, бумаги, линолеума. Более мягкий и тонкий продукт — так называемый осажденный К. к., полученный взаимодействием CaCl 2и Na 2CO 3— в производстве зубного порошка, косметических средств и т.д.
Кальция нитрат
Ка'льция нитра'т,то же, что кальциевая селитра .
Кальция окись
Ка'льция о'кись,негашёная известь, кипелка, CaO, соединение кальция с кислородом; бесцветные кристаллы, плотность 3,4 г/см 3 ,t пл2585 °С. Технический продукт — белое пористое вещество. К. о. жадно реагирует с водой с выделением большого количества тепла и образованием кальция гидроокиси :
CaO + H 2O = Ca (OH) 2
(процесс гашения). К. о. получают обжигом известняка или мела. Широко применяют в строительстве, в химической промышленности, металлургии, сельском хозяйстве, водоочистке и т.д. См. также Известь .
Кальция сульфат
Ка'льция сульфа'т,сернокислый кальций, CaSO 4, соль. Находится в природе в виде дигидрата CaSO 4×2H 2O (гипс, селенит) и в безводном состоянии — ангидрит. Безводный К. с. — бесцветные кристаллы, плотность 2,96 г/см 3 , t пл1450°C; очень медленно присоединяет воду. В воде растворим незначительно ( г на 100 г H 2O): 0,2036 (20 °С), 0,067 (100 °С). Известен так называемый полуобожжённый гипс CaSO4×1/2H 2O; будучи замешан в кашицу с водой, он быстро твердеет, превращаясь в CaSO 4×2H 2O. Применяют К. с. для изготовления фигур, слепков, как строительный материал (см. Гипс , Гипсовые вяжущие материалы ) и в медицине (см. Кальций ).
Кальция сульфид
Ка'льция сульфи'д,сернистый кальций, CaS, соль; бесцветные кристаллы, плотность 2,58 г/см 3 , t пл2000 °С. Получают К. с. при прокаливании CaSO 4с углём. Применяют для приготовления люминофоров , а также в кожевенной промышленности для удаления волос со шкур. Кальция гидросульфид, Ca (SH) 2, применяют в производстве искусственного волокна.
Кальция фосфаты
Ка'льция фосфа'ты,фосфорнокислые соли кальция, например Ca 3(PO 4) 2; см. Фосфаты кальция .
Кальция фторид
Ка'льция фтори'д,фтористый кальций, CaF 2, соль; бесцветные кристаллы, плотность 3,18 г/см 3 , t пл1360 °С. Практически нерастворим в воде. В природе встречается в виде минерала флюорита (плавиковый шпат), входит в состав апатита . Применяется как исходное сырьё для получения HF и других фтористых соединений и в металлургии как флюс.
Кальция хлорид
Ка'льция хлори'д,хлористый кальций, CaCl 2, соль; бесцветные кристаллы, плотность 2,51 г/см 3 , t пл772 °С. Жадно поглощает водяные пары, расплываясь в жидкость. Растворимость ( г на 100 г H 2O): 74(20 °С) и 159 (100 °С). Водные растворы К. х. замерзают при низких температурах (20%-ный при —18,57 °С, 30%-ный при —48 °С). CaCl 2образует гидрат CaCl 2×6H 2O, устойчивый до 29,8 °С; при более высоких температурах из насыщенного раствора выпадают кристаллогидраты с 4, 2 и 1 молекулами H 2O. При смешении CaCl 2×6H 2O (58,8%) со снегом или льдом (41,2%) температура понижается до —55 °С (криогидратная точка). К. х. получают как побочный продукт в производстве соды . Применяют для получения металлического кальция, для высушивания газов и жидкостей, в холодильном деле, медицине (см. Кальций ) и т.д.
Кальция цианамид
Ка'льция цианами'д,CaCN 2, то же, что цианамид кальция .
Калья
Калья',посёлок городского типа в Свердловской области РСФСР. Расположен в 19 км к С. от ж.-д. станции Бокситы. 11 тыс. жителей (1970). Добыча бокситов.
Читать дальшеИнтервал:
Закладка:
