БСЭ БСЭ - Большая Советская Энциклопедия (КА)
- Название:Большая Советская Энциклопедия (КА)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (КА) краткое содержание
Большая Советская Энциклопедия (КА) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
CH 2N 2®: CH 2+ N 2.
Аналогично могут быть получены и др. К. Дигалогенкарбены возникают при термическом разложении щелочных солей тригалогенуксусных кислот:
CCl 3COONa ®: CCl 2+ NaCl + CO 2.
К. стабилизируются различными путями в зависимости от условий генерации и природы взаимодействующих с ними соединений. Например, они могут димеризоваться: : CH 2+: CH 2® CH 2= CH 2; внедряться по связи углерод — водород, например в углеводороды R — Н +: СН2 ® R — CH 3; присоединяться по кратной связи (например, к этилену) с образованием трёхчленного цикла:
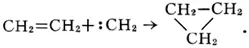
Последнюю реакцию широко применяют для синтеза различных трёхчленных циклических соединений.
Лит.: Кнунянц И. Л., Гамбарян Н. П., Рохлин Е. М., Карбены, «Успехи химии», 1958, т. 27, в. 12, с. 1361.
Б. Л. Дяткин.
Карбид бора
Карби'д бо'ра,см. Бора карбид.
Карбид кальция
Карби'д ка'льция,CaC 2, соединение кальция с углеродом; один из важнейших карбидов, применяемых в технике. Химически чистый К. к. бесцветен (технический — от светло-бурого до чёрного); плотность 2,2 г/см 3t пл 2300 °С. С водой взаимодействует с образованием ацетилена:
CaC 2+ 2H 2O = C 2H 2+ Ca (OH) 2;
для отвода выделяющейся теплоты (30,4 ккал/моль, т. е. 127,3 кдж/моль ) процесс ведут в избытке воды. К. к. при нагревании взаимодействует с азотом, образуя цианамид кальция:
CaC 2+ N 2= Ca (CN) 2.
Получают К. к. в электрических печах при 1900—1950° С по реакции:
CaO + 3C = CaC 2+ CO,
в которой поглощается большое количество тепла (450,5 кдж/моль ) . Сырьём служат известь и антрацит или кокс. Большинство действующих карбидных печей открыто сверху; CO по выходе из печи сгорает до СО 2.
Разработаны также конструкции закрытых печей с отбором CO 2. К. к. широко применяют в технике, главным образом для производства ацетилена, цианамида кальция и восстановления щелочных металлов.
Лит.: Кузнецов Л. А., Производство карбида кальция, М. — Л., 1950; Стрижевский И. И., Гузов С. Г. и Ковальский В. А., Ацетиленовые станции, 2 изд., М., 1959.
Карбид кремния
Карби'д кре'мния,карборунд, SiC, соединение кремния с углеродом; см. Кремния карбид.
Карбидкремниевые огнеупорные изделия
Карбидкре'мниевые огнеупо'рные изде'лия,изготовляются из карбида кремния (карборунда) с добавками и содержат от 20—35 до 70—98% SiC. К. о. и. различаются по способу связывания зёрен карбида кремния: на кремнезёмистой (образующейся при окислении карбида), нитридной (Si 3N 4), оксинитридной (Si 2ON 2), алюмосиликатной связках, а также рекристаллизованные, самосвязанные и др. Изделия формуют на прессах или другим способом из порошкообразных смесей, содержащих карбид кремния, и обжигают при 1300—1550 °С (некоторые виды — при 2000—2200 °С). Характерные свойства К. о. и.: высокая теплопроводность [7—17 вт/(м × К) при 800 °С] и связанная с этим хорошая термостойкость ; устойчивость против деформации при высоких температурах. При 1300—1500 °С в окислительной среде К. о. и. постепенно окисляются, особенно при избытке кислорода и в присутствии водяного пара. К. о. и. применяются, например, в рекуператорах, муфельных печах, агрегатах цветной металлургии, этажерках туннельных вагонеток при обжиге фарфора и керамики, котельных топках.
Лит.: Каинареки и И. С., Дегтярёва Э. В., Карборундовые огнеупоры, Хар., 1963.
А. К. Карклит.
Карбиды
Карби'ды, соединения углерода с электроположительными элементами, главным образом с металлами и некоторыми неметаллами По типу химической связи К. могут быть подразделены на три основные группы: ионные (или солеобразные), ковалентные и металлоподобные. Некоторые К. принадлежат к нестехиометрическим соединениям— твёрдым веществам переменного состава, не отвечающего стехиометрическим законам.
Ионные К. образуются сильно электроположительными металлами; они содержат катионы металлов и анионы углерода. К ним относятся ацетилениды с анионами [С º С] 2- , которые могут быть представлены как продукты замещения водорода в ацетилене C 2H 2металлами, а также метаниды — продукты замещения металлами водорода в метане CH 4.
Табл. 1 — Свойства некоторых ионных карбидов
| Карбид | Кристалличе- ская структура | Плот- ность, г/см 3 | Температура плавления, °С | Теплота образо- вания, ккал/моль* | Удельное объёмное электрическое сопро- тивление, мком × см |
| Ромбическая Гексагональная Гексагональная Тетрагональная Тетрагональная Тетрагональная Тетрагональная Тетрагональная Кубическая Ромбоэдрическая | 1,30 1,60 1,62 2,07 2,21 3,72 5,35 5,56 2,44 2,95 | — 800 (разл.) — — 2300 2000 (разл.) 2360 2290 2400 2100 | 14,2 — 4,1 — 21±5 14,1±2,0 12,l±4,0 38,0 — 28,0 49,5 | — — — — — — 45 60 1,1 .10 6— |
*1 ккал/моль = 4,19 кдж/моль.
Табл. 2. — Свойства некоторых металлоподобных и ковалентных карбидов
| Карбид | Границы области однородности, ат. %С | Кристалличе- ская струк тура а) | Плот- ность, г/см 3 | Темпе ратура плавле- ния, °С | Теплота образо- вания, ккал/моль д ) | Коэффициент терми- ческого рас- ширения (20-1800 °С) 1/ 1°С×10 6 | Теплопровод- ность, кал/см×сек× °С е) | Удельное объемное элетрическое соп- ротивление мком×см | Работа выхода элек- ронов ж)j эфф, эв | Микро- твер дость Гн/м 2 | Модуль упругос- ти Гн/м 2 |
| TiC | 37-50 | КГЦ | 4,94 | 3150 | 43,9 | 8,5 | 0,069 | 52,5 | 4,20 | 31 | 460 |
| ZrC | 38-50 | КГЦ | 6,60 | 3420 | 47,7 | 6,95 | 0,09 | 50 | 4,02 | 29 | 550 |
| HfC | 36-50 | КГЦ | 12,65 | 3700 | 55,0 | 6,06 | 0,07 | 45 | 3,95 | 28,5 | 359 |
| VC | 40-47 | КГЦ | 5,50 | 2850 | 24,1 | 7,2 | 0,094 | 76 | 4,07 | 25,5 | 431 |
| nвc | 41,2-50 | КГЦ | 7,80 | 3600 | 33,7 | 6,5 | 0,044 | 42 | 3,93 | 20,5 | 540 |
| TaC | 42,2-49 | КГЦ | 14,5 | 3880 | 34,0 | 8,29 | 0,053 | 24 | 3,82 | 16 | 500 |
| Cr 3C 2 | — | Ромбич. | 6,74 | 1895 | 8,1 | 11,7 | 0,046 | 75 | — | 13,3 | 380 |
| Mo 2C | 31,2-33,3 | ГПУ | 9,06 | 2580 | 11,0 | 7,8 | 0,076 | 71 | — | 15 | 544 |
| W 2C | 29,5-33,3 | ГПУ | 17,13 | 2795 | 7,9 | — | 0,072 | 75,5 | 4,58 | 14,5 | 428 |
| WC | — | Гексагон. | 15,70 | 2785 | 9,1 | 5,2 | 0,083 | 19,2 | — | 18 | 722 |
| Fe 3C | — | Ромбич. | 7,69 | 1650 | —5,4 | — | — | — | — | 10,8 | — |
| SiC | — | Гексагон. | 3,22 | 2827 б) | 15,8 | 4,7 в) | 0,24 | >0,13×10 6 | — | 33,4 | 386 |
| B 4C | 17,6-29,5 г) | Ромбоэдр. | 2,52 | 2250 б) | 13,8 | 4,5 в) | 0,29 | 9×10 5 | — | 49,5 | 480 |
а)КГЦ — кубическая гранецентрированная, Ромбич. — ромбическая. Ромбоэдр. — ромбоэдрическая, ГПУ — гексагональная плотноупакованная, Гекс. — гексагональная. б)Разлагается. в)20—1000 °С, г)% по массе, д)1 кал/моль = 4,19 кдж/моль. е) 1 кал/см × сек ×°С = 419 вт/(м × К ) . ж)При 1800 K.
Читать дальшеИнтервал:
Закладка:
