БСЭ БСЭ - Большая Советская Энциклопедия (КА)
- Название:Большая Советская Энциклопедия (КА)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (КА) краткое содержание
Большая Советская Энциклопедия (КА) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Кислотные свойства обусловлены способностью К. к. к диссоциации в водном растворе:
RCOOH Û RCOO -+ H +.
Как правило, К. к. слабее минеральных. Константы диссоциации одноосновных насыщенных кислот жирного ряда при 25°С изменяются от 1,7×10 -4(муравьиная кислота) до 1,3 . 10 -5(высшие гомологи). Сила К. к. существенно зависит также от электрофильности радикала, связанного с карбоксилом. Введение электроотрицательных заместителей (например, NO 2, CN, Cl) в положение, соседнее с карбоксильной группой, резко повышает кислотность, например циануксусная кислота CNCH 2COOH примерно в 200 раз сильнее уксусной кислоты CH 3COOH. По мере удаления от карбоксила влияние заместителей ослабевает. Дикарбоновые кислоты сильнее монокарбоновых, причём влияние одного карбоксила на другой тем больше, чем они ближе расположены друг к другу. Так, в ряду кислот щавелевая кислота HOOC—COOH сильнее малоновой кислоты HOOCCH 2COOH, которая, в свою очередь, сильнее янтарной HOOC (CH 2) 2COOH, и т.д. Кислотность непредельных кислот выше, чем предельных; влияние двойной связи тем сильнее, чем она ближе расположена к карбоксилу. Так, акриловая кислота CH 2=CH—СООН в 4 раза сильнее пропионовой CH 3—CH 2—COOH. Ароматические кислоты сильнее предельных алифатических (например, константа диссоциации бензойной кислоты 6,5 . 10 -5).
К. к. — жидкие (например, низшие жирные кислоты) или твёрдые (например, высшие жирные и ароматические кислоты) вещества (см. табл. ). Низшие члены насыщенных К. к. жирного ряда хорошо растворимы в воде, средние члены (C 4— C 10), а также ароматические кислоты — ограниченно, высшие жирные кислоты в воде не растворимы; как и ароматические кислоты, они хорошо растворяются в спирте, эфире, бензоле.
Наиболее важные химические свойства К. к. — способность превращаться в производные. При взаимодействии с основаниями К. к. дают соли:
RCOOH + NaOH ® RCOONa + H 2O.
При действии на К. к. спиртов в присутствии минеральных кислот легко образуются эфиры сложные:
RCOOH + R'OH ® RCOOR' + H 2O;
при действии галогенангидридов минеральных кислот (например, PCl 3, POCl 3, SOCl 2)— галогенангидриды К. к. RCOX (X — атом галогена). При нагревании кислот с водоотнимающими средствами получаются ангидриды К. к. (RCO) 2O. Галогенангидриды и ангидриды К. к. применяют как ацилирующие агенты. Отщепление воды от аммониевых солей К. к. (1) и реакция галогенангидридов с аммиаком (2) приводят к амидам кислот:
1) RCOONH 4® RCONH 2+ H 2O
2) RCOCI + 2NH 3® RCONH 2+ NH 4CI.
Методы получения К. к. весьма многочисленны. Окислением первичных спиртов и альдегидов получают К. к. с тем же числом атомов углерода. Окисление кетонов сопровождается разрывом связи С—С; из циклических кетонов образуются дикарбоновые кислоты, например адипиновая кислота из циклогексанона:
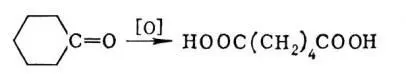
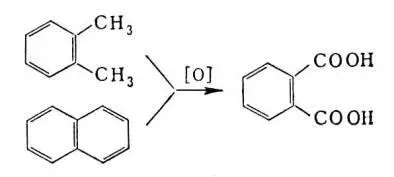
Насыщенные углеводороды могут быть подвергнуты деструктивному окислению с образованием смеси продуктов, в том числе и карбоновых кислот. Этим методом из 1 m парафина обычно получают около 350 кг К. к. Окисление боковой цепи жирно-ароматических углеводородов либо многоядерных ароматических углеводородов приводит к ароматическим К. к.; например, фталевая кислота получается окислением о -ксилола или нафталина:
Ненасыщенные углеводороды окисляются по месту двойной связи:
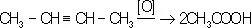 .
.
Важный метод синтеза К. к. — гидролиз их нитрилов, легко получаемых взаимодействием галогенопроизводных углеводородов с цианистым натрием:
RCI + NaCN ® RCN ® RCOOH.
В настоящее время промышленное значение приобрёл метод синтеза К. к. карбонилированием, т. е. введением группы CO в органические соединения:
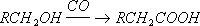
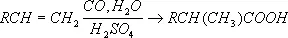
Некоторые К. к. получают из природных продуктов. Так, щелочным гидролизом (омылением) жиров получают соли высших жирных кислот (мыла) и глицерин. Лимонную кислоту получают из ботвы хлопчатника и из стеблей махорки (после выделения из них никотина). Многие К. к. получают сбраживанием углеводов в присутствии бактерий определённого вида (маслянокислое, молочнокислое, лимоннокислое и др. виды брожения).
К. к. широко распространены в природе в свободном состоянии и в виде производных (главным образом сложных эфиров). Так, в летучем масле герани содержится пеларгоновая кислота, в лимонах — лимонная. В состав животных и растительных жиров и масел входят глицериды высших нормальных К. к. жирного ряда, из которых преобладают пальмитиновая кислота, стеариновая кислота и олеиновая кислота.
К. к., их производные, а также многочисленные соединения, содержащие наряду с карбоксильной иные функциональные группы (например, аминокислоты, оксикислоты и др.), имеют большое биологическое значение и находят разнообразное практическое применение. Муравьиную и уксусную кислоты, например, применяют при крашении и печатании тканей; уксусную кислоту и уксусный ангидрид — в производстве ацетилцеллюлозы. Аминокислоты входят в состав белков. В медицине используют салициловую кислоту, n -аминосалициловую кислоту (ПАСК) и др.
Высшие жирные К. к. широко применяют как сырьё для производства мыла, лаков и красок, поверхностно-активных веществ, как эмульгаторы в производстве каучуков, как пластификаторы в производстве резин и др. Адипиновая кислота — один из исходных продуктов в производстве полиамидного волокна (найлона), терефталевая — в производстве полиэфирного волокна (лавсана, терилена), полимерный нитрил акриловой кислоты (орлон) применяют как синтетическое волокно, близкое по свойствам к натуральной шерсти. Полимеры и сополимеры эфиров метакриловой кислоты используют как органическое стекло.
Некоторые представители карбоновых кислот и их свойства
| Наименование | Формула | Температура плавления, °С | Температура кипения, °С | Плотность,* г/см 2 | |
| Алифатические (жирные) кислоты | |||||
| Муравьиная | НСООН | 8,4 | 100,5 | 1,220(20) | |
| Уксусная | СН 3СООН | 16,6 | 118,2 | 1,049(20) | |
| Пеларгоновая | СН 3(СН 2) 7СООН | 12,3 | 255,6 | 0,906(20) | |
| Пальмитиновая | СН 3(СН 2) 14СООН | 62,8 | 390 | 0,841(80) | |
| Стеариновая | СН 3(СН 2) 16СООН | 69,6 | 360 (с разложением) | 0,839(80) | |
| Адипиновая | НООС(СН 2) 4СООН | 153,5 | 265(100 мм рт. ст. ) ** | 1,366(20) | |
| Акриловая | СН 2=СНСООН | 12,3 | 140,0 | 1,062(16) | |
| Метакриловая | СН 2=С(СН З)СООН | 16 | 163 | 1,015(20) | |
| Олеиновая | СН 3(СН 2) 7СН=СН(СН 2) 7СООН | 16 | 223(10 мм рт. ст. ) | 0,895(18) | |
| Ароматические кислоты | |||||
| Бензойная | С 6Н 5СООН | 121,7 | 249,2 | 1.322(20) | |
| Коричная | С 6Н 5СН=СНСООН | 136 | 300 | 1,245(20) | |
| Терефталевая | n =НООСС 6Н 4СООН | — | 300 (возгоняется) | — | |
*В скобках указана температура (в °С). ** 1 мм рт. ст. = 133,322 н/м 2.
Читать дальшеИнтервал:
Закладка:
