БСЭ БСЭ - Большая Советская Энциклопедия (КА)
- Название:Большая Советская Энциклопедия (КА)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (КА) краткое содержание
Большая Советская Энциклопедия (КА) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
К. п. образуются в разнообразных условиях: в осадочно-морских (в морских отложениях карбонаты кальция слагают огромные толщи известняков частью биогенного происхождения и доломитов ) , в гидротермальных рудных месторождениях (кальцит, сидерит, анкерит ) , в коре выветривания ( магнезит ) , в метасоматических образованиях (магнезит, сидерит), в зоне окисления полиметаллических месторождений ( малахит, азурит, смитсонит, церуссит ) . Магматогенным путём возникают карбонатиты, с которыми связаны месторождения апатита и редких земель. Многие К. п. (например, смитсонит, малахит, церуссит, стронцианит, сидерит и др.) используются как руда на Zn, РЬ, Bi, Ba, Sr, Cu, Fe, Мп, редкие земли и др. металлы, как сырьё для цементной и химической промышленности (например, доломит, магнезит) и как строительный материал (известняк, мрамор).
Карбонизация
Карбониза'ция,1) насыщение какого-либо раствора углекислым газом CO 2. Широко применяется в содовом производстве, строительстве, пивоваренном деле и др. 2) Неправильное название способа разрушения растительных материалов (соломы, репейника и т.п.), содержащихся в рунной шерсти, или разрушения растительных волокон в полушерсти. К. осуществляется обработкой материалов растворами кислот или кислых солей.
Карбонилы металлов
Карбони'лы мета'ллов,соединения металлов с окисью углерода общей формулы Me m(CO) n. Впервые (в 1890) был открыт карбонил никеля Ni(CO) 4. С тех пор получены карбонилы многих металлов и некоторых неметаллов. В зависимости от числа атомов металла в молекуле К. м. могут быть «одноядерными» и «многоядерными»; известны также смешанные К. м., например [Co(CO) 4] 2Zn. О строении К. м. см. Комплексные соединения, Валентность.
Карбонилы никеля, железа, осмия, рутения — жидкости; большинство других К. м. — кристаллические вещества. К. м. диамагнитны, весьма летучи, чрезвычайно токсичны. Для меди, серебра, золота известны лишь карбонилгалогениды, Me(CO)X, устойчивые только в атмосфере окиси углерода. При нагревании выше определённой температуры К. м. разлагаются с выделением окиси углерода и металла в мелкодисперсном состоянии. Физические свойства важнейших К. м. приведены в таблице. Указанные в таблице К. м. хорошо растворимы в органических растворителях.
Физические свойства некоторых карбонилов металлов
| Карбо- нил ме- талла | t кип, °С | t пл, °С | Плотность (при 20 °С), г/см 3 | Раство- римость в воде |
| Fe(CO) 5 | 103 | —20 | 1,455 | — |
| Со(СО) 4 | — | 51 | 1,827 | не раст- ворим |
| Ni(CO) 4 | 43 | —19 | 1,310 | низкая |
| Ru(CO) 5 | — | —22 | — | не раст- ворим |
Общий способ получения К. м. заключается во взаимодействии окиси углерода с металлами или их солями при повышенных температурах и давлении. Наибольшее техническое значение имеют карбонилы никеля Ni(CO) 4, кобальта Со(СО) 4и железа Fe(CO) 3. Карбонилы применяют для получения чистых металлов, образующихся при их термическом разложении. Термическое разложение карбонилов кобальта, никеля и хрома используется для нанесения металлических покрытий, особенно на поверхности сложной формы. Карбопилы кобальта и никеля применяются в качестве катализаторов важных химических процессов. Их используют при синтезе карбоновых кислот и их производных из олефинов, акриловой кислоты из ацетилена, при гидроформилировании:
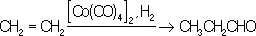
К. м. — хорошие антидетонаторы моторного топлива, однако при их сгорании образуются трудноудаляемые окислы. Некоторые карбонилы используются для получения совершенно чистой окиси углерода.
Лит.: Белозерский Н. А., Карбонилы металлов, М., 1958; Химия координационных соединений, ред. Дж. Бейлар, Д. Буш, пер. с англ., М., 1960, Химия металлоорганических соединении, под ред. Г. Цейсса, пер. с англ., М., 1964, с. 538—604.
Н. А. Несмеянов.
Карбония ионы
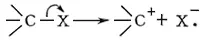
Карбо'ния ио'ны,карбкатионы, молекулярные частицы, содержащие трёхковалентный положительно заряженный атом углерода. К. и. обладают высокой реакционной способностью и поэтому малоустойчивы (ср. Карбанионы ) . К. и. образуются:
При гетеролитическом разрыве связи С — Х (электронная пара, осуществляющая эту связь, уходит вместе с группой X):
Например, действие сильных кислот на трифенилкарбинол даёт соль трифенилметилкатиона:
(C 6H 5) 3C—OH + H 2SO 4Û (С 6Н 5) 3С ++ НSО 4 -+ H 2O.
Этот К. и. устойчив вследствие распределения положительного заряда между несколькими атомами углерода.
При действии апротонных кислот на галогенпроизводные, например:
CCl 4+ AICI 3Û CCI 3 ++ AICl 4 -.
При присоединении протона или другого катиона по кратной связи:
(CH 3) 2C=CH 2+ H +Û (CH 3) 3C +
и др. способами.
К. и. легко реагируют с анионами, с молекулами, имеющими неподелённую электронную пару или кратную связь, и с др. соединениями, атакуя места с повышенной электронной плотностью. К. и. — промежуточные частицы в большом числе теоретически и практически важных органических реакций (например, алкилирование и ацилирование по Фриделю — Крафтсу, реакции электрофильного присоединения к олефинам, изомеризация и катионная полимеризация олефинов, пинаколиновая и ретропинаколиновая, Демьянова и Вагнера — Меервейна перегруппировки).
Лит.: Бреслоу Р., Механизмы органических реакций, пер. с англ., М., 1968; Робертс Дж., Касерио М., Основы органической химии, пер. с англ., ч. 1—2, М., 1968.
Б. Л. Дяткин.
Карбоновые кислоты
Карбо'новые кисло'ты,класс органических соединений, содержащих карбоксильную группу (карбоксил) 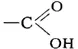 . В зависимости от природы радикала, связанного с группой — COOH, К. к. могут принадлежать к алифатическому (жирному), алициклическому, ароматическому или гетероциклическому ряду. По числу карбоксильных групп в молекуле различают одно-, двух- и многоосновные (соответственно моно-, ди- и поликарбоновые) кислоты. Кроме того, К. к. могут быть насыщенными (предельными) и ненасыщенными (непредельными), содержащими в молекулах двойные или тройные связи.
. В зависимости от природы радикала, связанного с группой — COOH, К. к. могут принадлежать к алифатическому (жирному), алициклическому, ароматическому или гетероциклическому ряду. По числу карбоксильных групп в молекуле различают одно-, двух- и многоосновные (соответственно моно-, ди- и поликарбоновые) кислоты. Кроме того, К. к. могут быть насыщенными (предельными) и ненасыщенными (непредельными), содержащими в молекулах двойные или тройные связи.
Большинство К. к. имеет тривиальные названия, многие из которых связаны с их нахождением в природе, например муравьиная, яблочная, валериановая, лимонная кислоты. По Женевской номенклатуре наименования К. к. производят от названий углеводородов с тем же числом атомов углерода, прибавляя окончание «овая» и слово «кислота», например метановая кислота (муравьиная), этановая кислота (уксусная) и т.д. Нередко К. к. рассматривают как производные углеводородов; например, кислоту строения HC º С — COOH называют ацетиленкарбоновой кислотой.
Читать дальшеИнтервал:
Закладка:
