БСЭ БСЭ - Большая Советская Энциклопедия (КР)
- Название:Большая Советская Энциклопедия (КР)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (КР) краткое содержание
Большая Советская Энциклопедия (КР) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Наибольшее значение Нк у чистых металлов достигает сотен гс. Если магнитное поле оказывается равным Нк только в некоторых точках поверхности сверхпроводника II рода, то в нём возникает промежуточное состояние (чередование сверхпроводящей и нормальной фаз).
В сверхпроводниках II рода (в основном это сплавы) проникновение магнитного поля начинается с образования вихревых нитей, в сердцевине которых в основном сосредоточено магнитное поле. При этом вещество ещё не теряет сверхпроводящих свойств, и в нём текут токи, частично экранирующие внешнее поле. Соответствующее началу проникновения К. м. п. Нк ,1 меньше термодинамического критического поля Нк для этих веществ. Полное проникновение магнитного поля в сверхпроводник наступает при Нк ,2 , которое может быть как меньше, так и больше Нк .В т. н. жёстких сверхпроводниках, из которых наиболее известны сплавы на основе ниобия, К. м. п. H k,2>> H k,1 и достигает сотен тыс. гс. При значениях поля H k,1 и H k,2 происходят фазовые переходы II рода. Подробнее см. Сверхпроводимость .
С. В. Иорданский.
Критическое состояние
Крити'ческое состоя'ние,
1) предельное состояние равновесия двухфазных систем, в котором обе сосуществующие фазы становятся тождественными по своим свойствам;
2) состояние вещества в точках фазовых переходов II рода. К. с., являющееся предельным случаем равновесия двухфазных систем, наблюдается в чистых веществах при равновесии жидкость — газ, а в растворах — при фазовых равновесиях газ — газ, жидкость — жидкость, жидкость — газ, твёрдое тело — твёрдое тело. На диаграммах состояния К. с. соответствуют предельные точки на кривых равновесия фаз ( рис. 1 , а и б) — т. н. критические точки . Согласно фаз правилу критическая точка изолирована в случае двухфазного равновесия чистого вещества, а, например, в случае бинарных (двойных) растворов критические точки образуют критическую кривую в пространстве термодинамических переменных (параметров состояния). Значения параметров состояния, соответствующие К. с., называются критическими — критическое давление рк ,критическая температура Тк ,критический объём V к ,критический состав хк и т. д.
С приближением к К. с. различия в плотности, составе и др. свойствах сосуществующих фаз, а также теплота фазового перехода и межфазное поверхностное натяжение уменьшаются и в критической точке равны нулю.
В том случае, когда кривая сосуществования фаз заканчивается критической точкой, оказывается принципиально возможным перевести вещество из одной фазы в другую, минуя область расслоения на две фазы (например, газ превратить в жидкость, изменяя его состояние по линии AB на рис. 1 , а, т. е. минуя область, где одновременно существуют газ и жидкость). Сжижение (конденсацию) газов возможно осуществить лишь после их охлаждения до температур, меньших Тк.
В двухкомпонентных системах характерные для К. с. явления наблюдаются не только в критической точке равновесия жидкость — газ, но и в так называемых критических точках растворимости, где взаимная растворимость компонентов становится неограниченной. Существуют двойные жидкие системы как с одной, так и с двумя критическими точками растворимости — верхней и нижней ( рис. 2 , а и б) . Эти точки являются температурными границами области расслаивания жидких смесей на фазы различного состава. Аналогичной способностью к расслаиванию при определённой критической температуре обладают некоторые растворы газов и твёрдые растворы.
Переход системы из однофазного состояния в двухфазное вне критической точки и изменение состояния в самой критической точке происходят существенно различным образом. В первом случае при расслоении на две фазы переход начинается с появления (или исчезновения) бесконечно малого количества второй фазы с конечным отличием её свойств от свойств первой фазы, что сопровождается выделением или поглощением теплоты фазового перехода. Поскольку возникновение такой новой фазы приводит к появлению поверхности раздела и поверхностной энергии, для её рождения требуются достаточно большие зародыши. Это означает, что при таком фазовом переходе (фазовом переходе 1 рода) возможны переохлаждение или перегрев первой фазы, обусловленные отсутствием жизнеспособных зародышей новой фазы.
Фазовые переходы в критических точках, являющихся предельными на кривых равновесия фаз, представляют собой частные случаи фазовых переходов II рода. В критической точке фазовый переход происходит в масштабах всей системы. Флуктуационно возникающая новая фаза по своим свойствам бесконечно мало отличается от свойств исходной фазы. Поэтому возникновение новой фазы не связано с поверхностной энергией, т. е. исключается перегрев или переохлаждение, и фазовый переход не сопровождается выделением или поглощением теплоты и скачком удельного объёма (фазовый переход II рода).
При приближении к К. с. физические свойства вещества резко изменяются: теоретически неограниченно возрастает теплоёмкость и восприимчивость системы к внешним воздействиям (например, изотермическая сжимаемость в случае чистых жидкостей, магнитная восприимчивость у ферромагнетиков и т. д.); наблюдается целый ряд др. особенностей в поведении вещества (см. Критические явления ) . Эти особенности, характерные для К. с. объектов самой различной природы, объясняются тем, что свойства вещества в К. с. определяются не столько конкретными законами взаимодействия его частиц, сколько резким возрастанием в веществе флуктуаций и радиуса их корреляции. Знание особых свойств веществ в К. с. необходимо во многих областях науки и техники: при создании энергетических установок на сверхкритических параметрах, сверхпроводящих систем, установок для сжижения газов, разделения смесей и т. д.
Лит.: Фишер М., Природа критического состояния, пер. с англ., М., 1968; Браут Р., фазовые переходы, пер. с англ., М., 1967; Ландау Л. Д., Лифшиц Е. М., Статистическая физика, 2 изд., М., 1964 (Теоретическая физика, т. 5); Кричевский И. Р., Фазовые равновесия в растворах при высоких давлениях, 2 изд., М.— Л., 1952.
С. П. Малышенко.
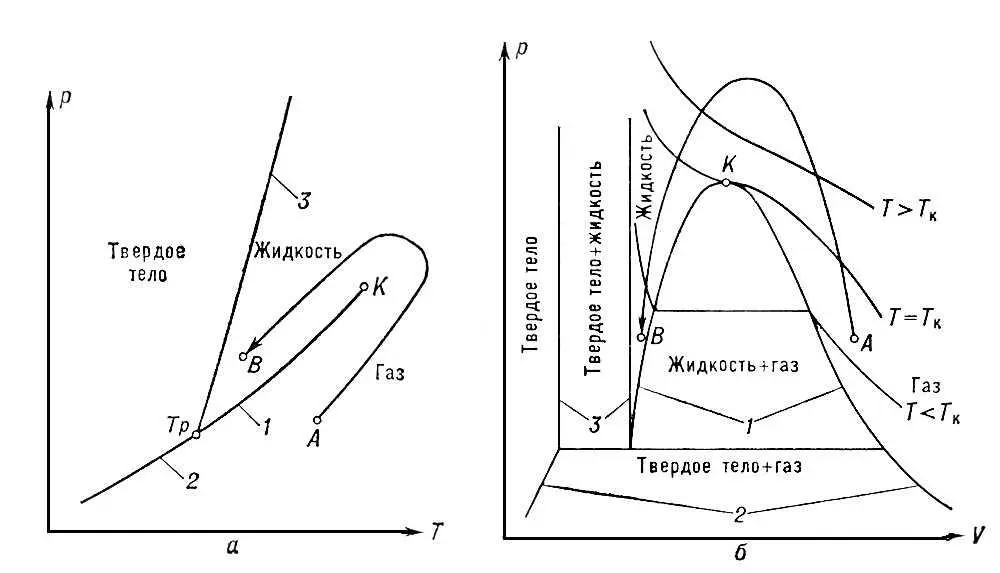
Рис. 1. а — диаграмма состояния чистого вещества в координатах р, Т. Кривые сосуществования обозначены цифрами: 1 — равновесие жидкость — газ, 2 — твёрдое тело; 3 — твёрдое тело — жидкость; К — критическая точка, Т = Т к— критическая изотерма; б — диаграмма в координатах р, V. Цифрами обозначены области сосуществования двух фаз: 1 — жидкость — газ; 2 — твёрдое тело — газ; 3 — твёрдое тело — жидкость.
Читать дальшеИнтервал:
Закладка:
