БСЭ БСЭ - Большая Советская Энциклопедия (КР)
- Название:Большая Советская Энциклопедия (КР)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (КР) краткое содержание
Большая Советская Энциклопедия (КР) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Практическое значение имеют: 1) полиборорганосилоксаны, которые применяют для изготовления клеев и самосклеивающихся резин; 2) полиалюмоорганосилоксаны — теплостойкие материалы в прецизионном литье металлов, катализаторы полимеризации при получении полиорганосилоксанов, а также плёнкообразующие для приготовления лаков, дающих термостойкие покрытия; 3) полититанорганосилоксаны — термостойкие материалы и герметики.
Полиорганосилазаны.Линейные полимеры — вязкие продукты, хорошо растворимые в органических растворителях, полимеры полициклической структуры — твёрдые бесцветные хрупкие вещества, имеющие температуру плавления от 150 до 320°С. Полиорганосилазаны устойчивы к действию воды в нейтральной и слабощелочной средах, но в кислой среде разлагаются; при нагревании со спиртом подвергаются алкоголизу.
Полимеры низкой молярной массы получают аммонолизом алкилхлорсиланов аммиаком или первичными аминами, например:
n (CH 3) 2SiCl 2+(2n-1) NH 3®H 2N—Si (CH 3) 2[—NH—Si (CH 3) 2—] n-1NH 2+2NH 4CI.
Эта реакция сопровождается образованием циклических соединений. Полимеры с молярной массой до 5000 получают ионной полимеризацией органоциклосилазанов.
Полиорганосилазаны находят практическое применение как гидрофобизаторы для различных строительных материалов и тканей, а также в качестве отвердителей кремнийорганических полимеров, эпоксидных смол и компаундов полимерных.
Полиорганоалкиленсиланы.Эти полимеры обладают довольно высокой термостойкостью. Т. к. полимерная цепь полиорганоалкиленсиланов содержит только связи Si—C и С—С, они отличаются высокой гидролитической устойчивостью и стойкостью к действию щелочей и кислот.
Высокомолекулярные полимеры этого класса получают полимеризацией силациклоалканов в присутствии металлоорганических катализаторов или взаимодействием гидросиланов с дивинилсиланами в присутствии H 2PtCl 6 , органических перекисей или третичных аминов. Полиорганоалкиленсиланы пока не нашли практического применения из-за относительно высокой стоимости соответствующих мономеров.
Прочие полимеры.Полиорганосиланы отличаются невысокой химической и термоокислительной стойкостью, т. к. связь Si—Si при действии щелочей или окислителей легко разрывается с образованием силанольной группировки Si—ОН. Поэтому практическое значение полиорганосиланов является проблематичным.
К. п. с органическими главными цепями макромолекул имеют меньшее практическое значение, чем, например, полиорганосилоксаны, т. к. они не обладают высокой теплостойкостью, присущей последним.
Лит.: Андрианов К. А., Полимеры с неорганическими главными цепями молекул, М., 1962; Бажант В., Хваловски В., Ратоуски И., Силиконы, [пер. с чеш.], М., 1960; Миле Р. Н., Льюис Ф. М., Силиконы, пер. с англ., М.,1964; Андрианов К. А., Теплостойкие кремнийорганические диэлектрики, М.— Л., 1964; Борисов С. Н., Воронков М. Г., Лукевиц Э. Я., Кремнеэлементоорга-нические соединения, [Л.], 1966; Андрианов К. А., Кремний, М., 1968 (Методы элементоорганической химии).
К. А. Андрианов.
Кремнийорганические соединения
Кремнийоргани'ческие соедине'ния,класс химических соединений, содержащих в молекулах связь кремний — углерод. К. с. подразделяют на следующие группы.
1) Органогалогенсиланы [алкил (арил)-галогенсиланы] R nSiX 4-n; органогидридгалогенсиланы R nSiH mX 4-(n+m)(где Х — чаще Cl); органоалкоксисиланы R nSi (OR') 4-n; органоацилоксисиланы R nSi (OCOR') 4-n; органоаминосиланы RnSi (NH 2) 4-n.
2) Органосиланы (замещенные силаны) R nSiH 4-n.
3) Органосилоксаны, включающие дисилоксаны R 3SiOSiR 3, трисилоксаны R 3SiOSi (R 2) OSiR 3и т. д.; циклосилоксаны (R2SiO) n, где n = 3—10 (чаще 3—4)
4) Гетероциклические соединения, например диметилсилациклобутан
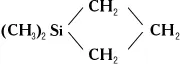
К соединениям первых двух групп примыкают близкие им по химическим свойствам соответствующие неорганические аналоги, такие, как галогенсиланы SiH mX 4-m(см. Кремния галогениды ) , силаны Si xH y(см. Кремневодороды ) , а также алкоксисиланы Si (OR) 4.
Получение. В промышленности наиболее важные К. с. получают главным образом непосредственным взаимодействием хлористых алкилов (арилов) с кремнием в присутствии меди; наряду с главным продуктом реакции 2RCI+Si®R 2SiCl 2образуется смесь различных соединений (RSiCI 3, R 3SiCl, RHSiCl 2и др.), которые также находят применение в промышленности, например для синтеза К. с. более сложной структуры или полимеров. К. с. получают также реакциями с металлоорганическими соединениями: CH 3SiCl 3+C 6H 5MgCl®CH 3(C 6H 5) SiCl 2+MgCI 2; термической конденсацией: CH 3SiHCl 2+CH 2=CHCl®CH 3(CH 2=CH) SiCl 2+HCI; жидкофазной дегидроконденсацией: CH 3SiHCl 2+C 6H 6®CH 3(C 6H 5) SiCl 2+H2; присоединением органогидридхлорсиланов к ненасыщенным соединениям: CH 3SiHCl 2+RCH=СН 2®CH 3(RCH 2CH 2) SiCl 2. Алкокси- и ацилоксисиланы получают чаще всего взаимодействием органохлорсиланов со спиртами, кислотами и др.
Свойства некоторых кремнийорганических соединений
| Соединение | t кип°C | Плотность при 20°С, г/см 3 |
| Диметилдихлорсилан (СН 3) 2SiCl 2 | 70,1 | 1,0637 |
| Триметилдихлорсилан (СН 3) 3SiCl | 57,7 | 0,8580 |
| Диэтилдихлорсилан (С 2Н 5) 2SiCl 2 | 128,9 | 1,0504 |
| Триэтилхлорсилан (С 2Н 5) 3SiCl | 146,0 | 0,8968 |
| Винилтрихлорсилан CH 2=CHSiCl 3 | 92,5 | 1,2426 |
| Фенилтрихлорсилан C 6H 5SiCl 3 | 201,0 | 1,3240 |
| Дифенилдихлорсилан (C 6H 5) 2SiCl 2 | 304,0 | 1,2216 |
| Метилфенилдихлорсилан CH 3(C 6H 5) SiCl 2 | 205,5 | 1,1866 |
| Метилтриметоксисилан CH 3Si (OCH 3) 3 | 103—105 | — |
| Метилтриметоксисилан CH 3Si (OC 2H 5) 3 | 151 | 0,9383 |
| Этилтриэтоксисилан C 2H 5Si (OC 2H 5) 3 | 159 | 0,9207 |
| Тетраэтоксисилан (C 2H 5O) 4Si | 166,5 | 0,9676 |
Свойства и применение. Почти все К. с. — бесцветные жидкости (см. табл.); лишь некоторые из них, например циклосилоксаны (R 2SiO) 3, — твёрдые кристаллические вещества. Обычно К. с. термически устойчивы (~600°С), перегоняются при атмосферном давлении и в вакууме; хорошо растворяются в углеводородах, хлорированных углеводородах, эфирах и др. органических растворителях; с водой не смешиваются. К. с. легко гидролизуются, особенно органохлорсиланы (дымят на воздухе):
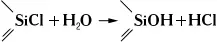
Образующиеся при гидролизе органогидроксисиланы вступают в межмолекулярную конденсацию с образованием органосилоксанов:
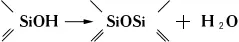
Под влиянием выделяющейся (или вводимой) кислоты происходит поликонденсация с образованием кремнийорганических полимеров. В соответствии с числом способных к гидролитическому отщеплению групп (обычно хлор, иногда алкокси-, ацилокси- или аминогруппы) различают моно-, ди-, три- и тетрафункциональные К. с., образующие при гидролизе соответственно дисилоксаны, смесь линейных полимеров HO (R 2SiO) nH и низкомолекулярных циклических диорганосилоксанов (R^SiO) n(в основном n= 4), полимеры циклолинейной и сшитой структур (RSiO 1,5) nи (SiO 2) n.
Читать дальшеИнтервал:
Закладка:
