БСЭ БСЭ - Большая Советская Энциклопедия (ОБ)
- Название:Большая Советская Энциклопедия (ОБ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ОБ) краткое содержание
Большая Советская Энциклопедия (ОБ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
В социалистических странах в рамках монополии внешней торговли и валютной монополии действует плановая О. в. Все внешнеторговые и некоторые др. организации получают право приобретать любую иностранную валюту для осуществления заключённых ими сделок. Комплексная программа социалистической экономической интеграции стран — членов СЭВ предусматривает совместную разработку странами — членами СЭВ условий и порядка осуществления мероприятий по введению обратимости коллективной валюты ( переводного рубля ) в национальную валюты стран — членов СЭВ и взаимной обратимости национальных валют.
М. П. Миронов.
Обратимые и необратимые реакции
Обрати'мые и необрати'мые реа'кции, типы реакций химических . Реакцию называют обратимой, если её направление зависит от концентраций веществ — участников реакции. Например, в случае гетерогенно-каталитической реакции
N 2+ 3H 2= 2NH 3(1)
при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении равновесия химического , система содержит как исходные вещества, так и продукты реакции. Реакцию называют необратимой, если она может происходить только в одном направлении и завершается полным превращением исходных веществ в продукты; пример — разложение взрывчатых веществ. Одна и та же реакция в зависимости от условий (от температуры, давления) может быть существенно обратима или практически необратима.
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция
N 2O 4Û 2NO 2(2)
складывается из элементарных реакций
N 2O 4®2NO 2и 2NO 2®N 2O 4.
Для обратимости сложной (многостадийной) реакции, например реакции (1), необходимо, чтобы были обратимы все составляющие её стадии.
М. И. Тёмкин.
Обратимый процесс
Обрати'мый проце'ссв термодинамике, процесс перехода термодинамической системы из одного состояния в другое, допускающий возможность возвращения её в первоначальное состояние через ту же последовательность промежуточных состояний, но проходимых в обратном порядке.
Для того чтобы процесс был обратимым, он должен быть столь медленным, чтобы его можно было рассматривать как непрерывный ряд равновесных состояний, т. е. он должен быть медленным по сравнению с процессами установления равновесия термодинамического в данной системе. Строго говоря, О. п. характеризуется бесконечно медленным изменением термодинамических параметров (плотности, давления, температуры и др.), определяющих равновесие системы. Такие процессы называются также квазистатическими или квазиравновесными. Обратимость квазиравновесного процесса следует из того, что его любое промежуточное состояние есть состояние термодинамического равновесия и поэтому оно не чувствительно к тому, идёт ли процесс в прямом или обратном направлении.
О. п. — одно из основных понятий равновесной макроскопической термодинамики . В её рамках первое и второе начала термодинамики формулируются для О. п.
Реальные процессы в природе протекают с конечной скоростью и сопровождаются рассеянием энергии (из-за трения, теплопроводности и др. аналогичных причин), поэтому они являются необратимыми процессами . О. п. есть идеализация процессов природы, протекающих столь медленно, что необратимыми явлениями для них можно пренебречь. Микроскопическая теория О. п. рассматривается в статистической физике .
Лит.: Ван-дер-Ваальс И. Д. и Констамм Ф., Курс термостатики, ч. 1, Общая термостатика, пер. с нем., М., 1936; Зоммерфельд А., Термодинамика и статическая физика, пер. с нем., М., 1955; Леонтович М. А., Введение в термодинамику, 2 изд., М. — Л., 1952; Ландау Л. Д. и Лифшиц Е. М., Статистическая физика, 2 изд., М. — Л., 1964 (Теоретическая физика, т. 5); Кубо P., Термодинамика, пер. с англ., М., 1970.
Д. Н. Зубарев.
Обратная конденсация
Обра'тная конденса'ция, ретроградная конденсация, выпадение жидкой фазы в двух- или многокомпонентной газовой системе вблизи её критической точки при изотермическом снижении давления, фазовая диаграмма такой системы в переменных Т—р приведена на рис . В отличие от индивидуальных веществ, у которых границей раздела жидкой фазы и пара является кривая кипения A 1K 1 , заканчивающаяся в критической точке K 1 , диаграмма фазового состояния смеси имеет вид петлеобразной кривой АКВ , внутри которой смесь находится в двухфазном состоянии (жидкость + пар). Кривые кипения АК и конденсации KB смеси смыкаются в критической точке К , где исчезает различие в свойствах обеих фаз. В области температур от Т к до Т т при изотермическом снижении давления, например по изотерме cd , из однородной газовой фазы выпадают капли жидкости (в точке с ), количество жидкости постепенно увеличивается до максимального значения в точке F , а затем начинает снижаться, и в точке d жидкая фаза исчезает полностью (т. н. изотермическая О. к. или О. к. первого рода). Зона KMG , в которой происходит аномальное выделение конденсата при снижении р , называется областью О. к. (слово «обратная» указывает на возвращение системы вновь в двухфазное состояние). Широкое практическое применение явление изотермической О. к. получило при добыче конденсата газового из газоконденсатных месторождений природного газа.
При пересечении двухфазной области по адиабате в интервале давлений от р к до р т , например по линии ab , в однородной жидкой смеси появляются пузырьки газа (в точке а ), количество газа с ростом Т сначала увеличивается, а затем убывает и в точке b система вновь становится жидкой (т. н. обратное испарение или О. к. второго рода).
Лит.: Карапетьянц М. Х., Химическая термодинамика, 2 изд., М. — Л., 1953, с. 317—18; Руководство по добыче, транспортировке и переработке природного газа, [М.], 1965, с. 75—76.
Б. В. Дегтярев.
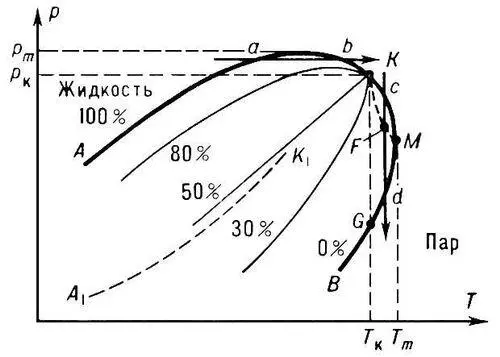
Фазовая диаграмма двухкомпонентной системы постоянного состава вблизи критической точки К жидкость — пар ( Т — температура, p — давление).
Читать дальшеИнтервал:
Закладка:
