БСЭ БСЭ - Большая Советская Энциклопедия (ОК)
- Название:Большая Советская Энциклопедия (ОК)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ОК) краткое содержание
Большая Советская Энциклопедия (ОК) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Окинский хребет
Оки'нский хребе'т, горный хребет Восточного Саяна, на границе Бурятской АССР и Иркутской области РСФСР. Образует водораздел рр. Ия и Хойто-Ока (бассейн Ангары). Высота около 2500 м . Длина около 100 км . Сложен гнейсами, кристаллическими сланцами, гранитами. На склонах горная тайга, до высоты 1000—2000 м — преимущественно кедровая, выше — горная тундра.
Окип
Оки'п(Okiep), горнопромышленный пункт на западе ЮАР, в Капской провинции. Около 5,7 тыс. жителей. К О. прилегает др. горнопромышленный пункт Набабип (около 8,3 тыс. жителей). Автодорогой связан с портом Порт-Ноллот. Центр добычи медных руд, месторождения которых эксплуатируются американской компанией «Окип коппер компани». Обогатительная фабрика. Медеплавильный завод.
Окисление
Окисле'ние, окислительный процесс, в узком смысле слова — реакция соединения какого-либо вещества с кислородом. В более широком смысле — всякая химическая реакция, сущность которой состоит в отнятии электронов от атомов или ионов (см. Окисление-восстановление ). Из обычных окислителей к числу важнейших относятся: кислород О 2, озон О 3, перекись водорода H 2O 2,хлор Cl 2, фтор F 2, перманганат калия KMnO 4, хлорная кислота HClO 24, азотная кислота HNO 3и др. См. также Электролиз .
Окисление - восстановление
Окисле'ние-восстановле'ние, окислительно-восстановительные реакции, химические реакции, сопровождающиеся изменением окислительных чисел атомов. Первоначально (со времени введения в химию кислородной теории горения А. Лавуазье , конец 18 в.) окислением назывались только реакции соединения с кислородом, восстановлением — отнятие кислорода. С введением в химию электронных представлений (1920—30) оказалось возможным широко обобщить понятие О.-в. и распространить его на реакции, в которых кислород не участвует. Согласно электронной теории, окислением называется отдача электронов атомом, молекулой или ионом: Zn – 2  = Zn 2+.
= Zn 2+.
Восстановлением называется присоединение электронов атомом, молекулой или ионом: Cl 2+ 2  = 2Cl –.
= 2Cl –.
Окислителями называется нейтральный атом, молекула или ион, принимающие электроны (во втором примере молекула хлора Cl 2), восстановителями — нейтральный атом, молекула или ион, отдающие электроны (в первом примере — атом Zn). Окисление и восстановление — взаимосвязанные процессы, которые всегда протекают одновременно. Когда одно вещество окисляется, то другое восстанавливается, и наоборот. Так, приведённые выше частные реакции окисления и восстановления составляют единый процесс О.-в.: Zn + Cl 2= ZnCl 2.
Здесь Zn окисляется до Zn 2+, а Cl 2восстанавливается до 2Cl –.
В химии окислительно-восстановительные реакции принадлежат к числу наиболее распространённых. Например, на них, как правило, основано получение простых веществ (металлов и неметаллов)
CuO + H 2=Cu + H 2O,
2КВг + Cl 2= Br 2+ 2KCl.
В основе технического производства таких важнейших химических продуктов, как аммиак , азотная кислота , серная кислота , процессов сжигания топлива и горения также лежат реакции О.-в. В гальванических элементах (см. Химические источники тока ) возникновение электродвижущей силы обусловлено протеканием реакции О.-в. При проведении электролиза на аноде происходит электрохимическое окисление, на катоде — электрохимическое восстановление. Например, при производстве хлора электролизом раствора NaCl на аноде идёт реакция Cl –– 1  = 1/2Cl 2(окисление аниона Cl –), на катоде Н ++ 1
= 1/2Cl 2(окисление аниона Cl –), на катоде Н ++ 1  = 1/ 2Н 2(восстановление катиона Н +). Коррозия металлов также связана с реакциями О.-в. и заключается в окислении металлов.
= 1/ 2Н 2(восстановление катиона Н +). Коррозия металлов также связана с реакциями О.-в. и заключается в окислении металлов.
Дыхание, усвоение растениями углекислого газа с выделением кислорода (см. Фотосинтез ), обмен веществ и др. биологически важные явления представляют собой реакции О.-в. (см. Окисление биологическое ).
При составлении уравнений реакций О.-в. основная трудность заключается в подборе коэффициентов, особенно для реакций с участием соединений, в которых химическая связь носит не ионный, а ковалентный характер. В этом случае полезны понятия электроотрицательности и окислительного числа (степени окисления). Электроотрицательность — способность атома в молекуле притягивать и удерживать около себя электроны. Степень окисления — такой заряд, который возник бы на атоме в молекуле, если бы каждая пара электронов, связывающая его с др. атомами, была полностью смещена к более электроотрицательному атому (см. Валентность ). Нахождение степени окисления атома в молекуле основано на том, что молекула в целом должна быть электрически нейтральной. При этом учитывается, что степень окисления атомов некоторых элементов в соединениях всегда постоянна (щелочные металлы +1, щёлочноземельные металлы и цинк +2, алюминий +3, кислород, кроме перекисей, –2 и т.д.). Степень окисления атома в простых веществах равна нулю, а одноатомного иона в ионном соединении равна заряду этого иона. Например, рассчитаем степень окисления атома Cr в соединении K 2Cr 2O 7. Пользуясь постоянными значениями степеней окисления для К и О, имеем 2·(+1) + 7·(–2) = –12. Следовательно, степень окисления одного атома Cr (чтобы сохранить электронейтральность молекулы) равна +6. На основе введённых понятий можно дать другое определение О.-в.: окислением называется увеличение степени окисления, восстановлением называется понижение степени окисления.
Восстановителями являются почти все металлы в свободном состоянии, отрицательно заряженные ионы неметаллов (S 2– – 2  = S°), положительно заряженные ионы металлов в низшей степени окисления (
= S°), положительно заряженные ионы металлов в низшей степени окисления ( 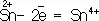 ), сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления (
), сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления ( 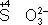 ,
, 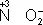 ). В промышленности и технике широко используются такие восстановители, как углерод и окись углерода (восстановление металлов из окислов)
). В промышленности и технике широко используются такие восстановители, как углерод и окись углерода (восстановление металлов из окислов)
ZnO + С = Zn + СО, FeO +СО = Fe + СО 2.
сульфит натрия Na 2SO 3и гидросульфит натрия NaHSO 3— в фотографии и красильном деле, металлический натрий и свободный водород — для получения чистых металлов
TiCl 4+ 4Na = Ti + 4NaCI,
GeO 2+2Н 2= Ge + 2H 2O.
Окислителями могут быть нейтральные атомы неметаллов (в особенности галогенов и кислорода), положительно заряженные ионы металлов в высшей степени окисления (Sn 4++ 2  = Sn 2+), сложные ионы и молекулы, содержащие атомы элементов в более высокой степени окисления (
= Sn 2+), сложные ионы и молекулы, содержащие атомы элементов в более высокой степени окисления ( 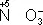 ,
, 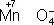 ,
, 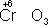 ). Промышленное значение как окислители имеют: кислород (особенно в металлургии), озон, хромовая и двухромовая кислоты и их соли, азотная кислота, перекись водорода, перманганат калия, хлорная известь и др. Самый сильный окислитель — электрический ток (окисление происходит на аноде).
). Промышленное значение как окислители имеют: кислород (особенно в металлургии), озон, хромовая и двухромовая кислоты и их соли, азотная кислота, перекись водорода, перманганат калия, хлорная известь и др. Самый сильный окислитель — электрический ток (окисление происходит на аноде).
Интервал:
Закладка:
