БСЭ БСЭ - Большая Советская Энциклопедия (ОК)
- Название:Большая Советская Энциклопедия (ОК)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ОК) краткое содержание
Большая Советская Энциклопедия (ОК) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Для подбора коэффициентов в уравнениях реакций О.-в. служит общее правило: число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем. Применяют обычно два метода подбора коэффициентов: метод электронного баланса и электронно-ионный метод.
В методе электронного баланса подсчёт числа принятых и отданных электронов производят на основании значений степеней окисления элементов до и после реакции. Например,
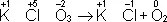
Таким образом, 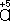 является окислителем, а
является окислителем, а  — восстановителем. Составляют частные реакции окисления и восстановления:
— восстановителем. Составляют частные реакции окисления и восстановления:
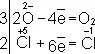
В соответствии с приведённым выше правилом числа отданных и принятых электронов уравнивают. Полученные величины подставляют в исходное уравнение:
2KClO 3= 2KCl + 3O 2.
В электронно-ионном методе схему реакции записывают в соответствии с общими правилами составления ионных реакций, т. е. сильные электролиты записывают в виде ионов, а неэлектролиты, слабые электролиты, газы и осадки — в виде молекул. Не изменяющиеся в результате реакции ионы в такую схему не входят. Например,
KMnO 4+ KI + H 2SO 4® K 2SO 4+ I 2+ MnSO 4+ H 2O,
в ионном виде:
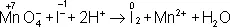
Рассчитав степени окисления, определяют окислитель и восстановитель и составляют частные реакции окисления и восстановления:
2I –– 2  = I 2,
= I 2,
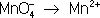
Во втором уравнении, перед тем как записать переход электронов, необходимо составить «материальный» баланс, т.к. в левой части уравнения есть атомы О, а в правой их нет. Избыточные атомы О связываются в молекулы воды ионами Н +, присутствующими в сфере реакции (кислая среда):
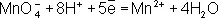
Далее, как и в первом методе, находят коэффициенты-множители к частным уравнениям для достижения электронного баланса (в приведённом примере 5 и 2 соответственно). Окончательное уравнение имеет вид:
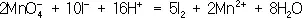 .
.
Полученные коэффициенты подставляют в исходное уравнение:
2KMnO 4+ 10KI + 8H 2SO 4= 6K 2SO 4+ 5I 2+ 2MnSO 4+ 8H 2O.
Аналогично составляют и уравнения реакций О.-в. в щелочной среде (вместо ионов Н +в частных уравнениях фигурируют ионы OH –). Т. о., в уравнивании реакций по второму методу учитывают характер реакционной среды (кислая или щелочная либо нейтральная), которая сильно влияет и на направление реакции О.-в. и на продукты, получаемые в результате реакции. Например, равновесие окислительно-восстановительной реакции 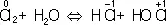 в кислой среде смещено влево, а в щелочной — вправо. Сильный окислитель ион
в кислой среде смещено влево, а в щелочной — вправо. Сильный окислитель ион 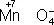 в кислой среде восстанавливается до иона Mn 2+, в щелочной среде — до иона
в кислой среде восстанавливается до иона Mn 2+, в щелочной среде — до иона 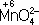 , в нейтральной — до молекулы
, в нейтральной — до молекулы 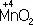 . См. также Окисление металлов , Восстановление металлов .
. См. также Окисление металлов , Восстановление металлов .
Лит.: Кудрявцев А. А., Составление химических уравнений, М., 1968; Химия. Курс для средней школы, пер. с англ., 2 изд., М., 1972, гл. 12; Химия. Пособие для преподавателей средней школы, пер. с англ., ч. 1, М., 1973, гл. 12.
В. К. Бельский.
Окисление биологическое
Окисле'ние биологи'ческое, совокупность реакций окисления, протекающих во всех живых клетках. Основная функция О. б. — обеспечение организма энергией в доступной для использования форме. Реакции О. б. в клетках катализируют ферменты, объединяемые в класс оксидоредуктаз . Изучение окисления в организме было начато в 18 в. А. Лавуазье ; в дальнейшем значительный вклад в исследование О. б. (его локализация в живых клетках, связь с др. процессами обмена веществ, механизмы ферментативных окислительно-восстановительных реакций, аккумуляция и превращение энергии и др.) внесли О. Варбург , Г. Виланд (Германия), Д. Кейлин , Х. Кребс , П. Митчелл (Великобритания), Д. Грин , А. Ленинджер , Б. Чанс, Э. Рэкер (США), а в СССР — А. Н. Бах , В. И. Палладин , В . А. Энгельгардт , С. Е. Северин , В. А. Белицер , В. П. Скулачев и др.
О. б. в клетках связано с передачей т. н. восстанавливающих эквивалентов (ВЭ) — атомов водорода или электронов — от одного соединения — донора, к другому — акцептору. У аэробов — большинства животных, растений и многих микроорганизмов — конечным акцептором ВЭ служит кислород. Поставщиками ВЭ могут быть как органические, так и неорганические вещества (см. таблицу).
Классификация организмов по источнику энергии и восстанавливающих эквивалентов
| Тип организмов | Источник энергии | Окисляемое соединение (поставщик восстанавливающих эквивалентов) | Примеры |
| Фотолитотрофы Фотоорганотрофы Хемолитотрофы Хемоорганотрофы | Свет Свет Реакции окисления Реакции окисления | Неорганические соединения (Н 2О, H 2S, S) Органические соединения Неорганические соединения (H 2, S, H 2S, NH 3, Fe 2 +) Органические соединения | Зелёные клетки высших растений, синезелёные водоросли, фотосинтезирующие бактерии Несерные пурпурные бактерии Водородные, серные, денитрифицирующие бактерии, железобактерии Животные, большинство микроорганизмов, нефотосинтезирующие клетки растений |
Основной путь использования энергии, освобождающейся при О. б., — накопление её в молекулах аденозинтрифосфорной кислоты (АТФ) и др. макроэргических соединений . О. б., сопровождающееся синтезом АТФ из аденозиндифосфорной кислоты (АДФ) и неорганического фосфата, происходит при гликолизе , окислении a-кетоглутаровой кислоты и при переносе ВЭ в цепи окислительных (дыхательных) ферментов, обычно называют окислительным фосфорилированием (см. схему ).
В процессе дыхания углеводы, жиры и белки подвергаются многоступенчатому окислению, которое приводит к восстановлению основных поставщиков ВЭ для дыхательных флавинов, никотинамидадениндинуклеотида (НАД), никотинамидадениндинуклеотидфосфата (НАДФ) и липоевой кислоты . Восстановление этих соединений в значительной мере осуществляется в трикарбоновых кислот цикле , которым завершаются основные пути окислительного расщепления углеводов (оно начинается с гликолиза), жиров и аминокислот. Помимо цикла трикарбоновых кислот, некоторое количество восстановленных коферментов — ФАД ( флавинадениндинуклеотида ) и НАД — образуется при окислении жирных кислот, а также при окислительном дезаминировании глутаминовой кислоты (НАД) и в пентозофосфатном цикле (восстановленный НАДФ).
Читать дальшеИнтервал:
Закладка:
