БСЭ БСЭ - Большая Советская Энциклопедия (СЕ)
- Название:Большая Советская Энциклопедия (СЕ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (СЕ) краткое содержание
Большая Советская Энциклопедия (СЕ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Техника безопасности. В производстве С. к. опасность представляют ядовитые газы (SO 2и NO 2), а также пары SO 3и H 2SO 4. Поэтому обязательны хорошая вентиляция, полная герметизация аппаратуры. С. к. вызывает на коже тяжёлые ожоги, вследствие чего обращение с ней требует крайней осторожности и защитных приспособлений (очки, резиновые перчатки, фартуки, сапоги). При разбавлении надо лить С. к. в воду тонкой струей при перемешивании. Приливание же воды к С. к. вызывает разбрызгивание (вследствие большого выделения тепла).
Лит.: Справочник сернокислотчика, под ред. Малина К. М., 2 изд., М., 1971; Малин К. М., Аркин Н. Л., Боресков Г. К., Слинько М. Г., Технология серной кислоты, М., 1950; Боресков Г. К., Катализ в производстве серной кислоты, М. — Л., 1954; Амелин А. Г., Яшке Е. В., Производство серной кислоты, М., 1974; Лукьянов П. М., Краткая история химической промышленности СССР, М., 1959.
И. К. Малина.
Серная мазь
Се'рная мазь,лекарственное средство, состоящее из очищенной серы и консистентной эмульсии (вода, вазелин). Применяют при лечении чесотки и других кожных заболеваний.
Серная пробка
Се'рная про'бка,скопление серы в наружном слуховом проходе человека; может закрыть его просвет. Признаки образования С. п. — снижение слуха, ощущение шума в ухе, аутофония (больной ощущает резонанс своего голоса в ухе). С. п. чаще удаляют промыванием, иногда — с помощью специального инструмента.
Сернистая кислота
Серни'стая кислота',H 2SO 3, слабая двухосновная кислота, отвечающая степени окисления серы +4. Известна только в разбавленных водных растворах. Константы диссоциации: K 1= 1,6 · 10 -2, K 2= 1,0 · 10 -7(18°C). Даёт два ряда солей: нормальные — сульфиты и кислые — гидросульфиты . H 2SO 3— сильный восстановитель (растворы её уже при стоянии на воздухе постепенно превращаются в H 2SO 4), при взаимодействии с более сильными восстановителями (например, H 2S) выступает как окислитель. Получают растворением SO 2в воде. В водных растворах одновременно имеют место следующие равновесия:
H 2O + SO 2Û H 2SO 3Û Н ++ HSO 3 -Û 2H ++SO 3 -
Продукты присоединения С. к. к органическим красящим веществам бесцветны или слабо окрашены. На этом основано применение С. к. для беления таких материалов, которые не выдерживают действия сильных окислителей, например хлора и гипохлоритов.
Сернистокислые соли
Сернистоки'слые со'ли,то же, что сульфиты .
Сернистые красители
Серни'стые краси'тели,органические красители, представляющие собой высокомолекулярные соединения, содержащие гетероциклы
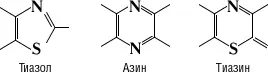
и группы SH и S n, где n ³ 2 (химическое строение точно не установлено). С. к. — аморфные вещества, нерастворимые в воде и в большинстве органических растворителей; при действии Na 2S образуют растворимые в воде лейкосоединения по схеме:
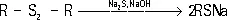
которые после крашения окисляются кислородом воздуха, вновь превращаясь на волокне в нерастворимые С. к. Получают С. к. длительным нагреванием различных органических соединений: ароматических амино-, нитро-, аминоокси- и нитрооксисоединений, гетероциклических азинов и других с серой или с полисульфидом натрия Na 2S n( n = 2 — 9). С. к. обычно неярки. Наибольшее значение имеют чёрные, синие, коричневые и зелёные; меньшее — жёлтые и оранжевые; С. к. красного цвета неизвестны. Чёрные С. к. дают достаточно устойчивые окраски, другие — менее прочные. Это недорогие красители, удобные в применении; широко используются для окраски хлопчато-бумажных тканей; в текстильной промышленности частично заменяются кубовыми красителями и реактивными красителями для получения более ярких и прочных окрасок.
Лит.: Чекалин М. А., Пассет Б. В., Иоффе Б. А., Технология органических красителей и промежуточных продуктов, Л., 1972.
М. А. Чекалин.
Сернистые металлы
Серни'стые мета'ллы,то же, что сульфиды .
Сернистый ангидрид
Серни'стый ангидри'д,серы двуокись, оксид серы (IV) SO 2, бесцветный газ с характерным резким запахом. В природе встречается в вулканических газах . При — 10,5 °С сгущается в бесцветную жидкость, затвердевающую при — 75 °С в кристаллическую массу. Критическая температура 157,3 °С, критическое давление 77,8 атм .
SO 2хорошо растворим в воде с образованием сернистой кислоты H 2SO 3. Кислород окисляет SO 2при высоких температурах в присутствии катализаторов; может окисляться до SO 3и H 2SO 4и восстанавливаться до S; с водными растворами щелочей SO 2образует соли сернистой кислоты. Термически SO 2очень устойчив; заметная диссоциация его на S и O 2или SO и О происходит лишь около 2800 °С.
В лаборатории получают действием H 2SO 4на гидросульфиты, например
2NaHSO 3+ H 2SO 4= Na 2SO 4+ 2SO 2+ 2H 2O или нагреванием медных стружек с концентрированной серной кислотой
Cu + 2H 2SO 4= CuSO 4+ SO 2+ 2H 2O.
О промышленном получении см. Серная кислота .
Основная область применения SO 2— производство серной кислоты; применяется в бумажной и текстильной промышленности, а также для сульфатации овощей и фруктов. Большая теплота испарения и лёгкая конденсируемость позволяют использовать его в холодильной технике. Как сильный восстановитель в водных растворах SO 2обесцвечивает многие органические красители и применяется при отбеливании тканей, сахара и др.
С. а. токсичен. Он может поступать в организм через дыхательные пути во время обжига серных руд (при получении серной кислоты) на медеплавильных заводах, при сжигании содержащего серу топлива в кузницах, котельных, на суперфосфатных заводах, тепловых электростанциях и т. п. В лёгких случаях отравления С. а. появляются кашель, насморк, слезотечение, чувство сухости в горле, осиплость, боль в груди; при острых отравлениях средней тяжести, кроме того, головная боль, головокружение, общая слабость, боль в подложечной области; при осмотре — признаки химического ожога слизистых оболочек дыхательных путей. Длительное воздействие С. а. может вызвать хроническое отравление. Оно проявляется атрофическим ринитом , поражением зубов, часто обостряющимся токсическим бронхитом с приступами удушья. Возможны поражение печени, системы крови, развитие пневмосклероза . Профилактика: герметизация производственного оборудования, эффективная вентиляция, улавливание С. а. из хвостовых и дымовых газов, индивидуальная защита органов дыхания (противогаз). Максимально допустимая концентрация С. а. в воздухе производственных помещений 1,0 мг/м 3 . Среднесуточная концентрация в населённых пунктах не должна превышать 0,15 мг/м 3 . Ежегодно в атмосферу выбрасываются десятки млн. т С. а., образующегося при промышленном сжигании углей и нефти, содержащих соединения серы. Очистка отбросных газов от С. а. — важная научно-техническая задача.
Читать дальшеИнтервал:
Закладка:
