БСЭ БСЭ - Большая Советская Энциклопедия (ТИ)
- Название:Большая Советская Энциклопедия (ТИ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ТИ) краткое содержание
Большая Советская Энциклопедия (ТИ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Физические свойства. Т. существует в виде двух аллотропических модификаций: ниже температуры 882,5 °С устойчива a-форма с гексагональной плотноупакованной решёткой ( а = 2,951 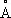 , с = 4,679
, с = 4,679 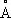 ), а выше этой температуры — b-форма с кубической объёмно-центрированной решёткой а = 3,269
), а выше этой температуры — b-форма с кубической объёмно-центрированной решёткой а = 3,269 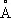 . Примеси и легирующие добавки могут существенно изменять температуру a/b превращения.
. Примеси и легирующие добавки могут существенно изменять температуру a/b превращения.
Плотность a-формы при 20 °С 4,505 г/см 3а при 870 °С 4,35 г/см 3 b-формы при 900 °С 4,32 г/см 3; атомный радиус Ti 1,46 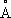 , ионные радиусы Ti +0,94
, ионные радиусы Ti +0,94 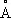 , Ti 2+0,78
, Ti 2+0,78 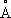 , Ti 3+0,69
, Ti 3+0,69 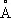 , Ti 4+0,64
, Ti 4+0,64 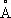 , t пл1668±5°С, t кип3227 °С; теплопроводность в интервале 20—25 °С 22,065 вт/ ( м × К) [0,0527 кал/ ( см × сек × °С)]; температурный коэффициент линейного расширения при 20 °С 8,5×10 -6, в интервале 20—700 °С 9,7×10 -6; теплоёмкость 0,523 кдж/ ( кг × К) [0,1248 кал/ ( г ×°С)]; удельное электросопротивление 42,1×10 -6 ом × см при 20 °С; температурный коэффициент электросопротивления 0,0035 при 20 °С; обладает сверхпроводимостью ниже 0,38±0,01 К. Т. парамагнитен, удельная магнитная восприимчивость (3,2±0,4)×10 -6при 20°С. Предел прочности 256 Мн/м 2(25,6 кгс/мм 2) , относительное удлинение 72%, твёрдость по Бринеллю менее 1000 Мн/м 2(100 кгс/мм 2) . Модуль нормальной упругости 108000 Мн/м 2(10800 кгс/мм 2) . Металл высокой степени чистоты ковок при обычной температуре.
, t пл1668±5°С, t кип3227 °С; теплопроводность в интервале 20—25 °С 22,065 вт/ ( м × К) [0,0527 кал/ ( см × сек × °С)]; температурный коэффициент линейного расширения при 20 °С 8,5×10 -6, в интервале 20—700 °С 9,7×10 -6; теплоёмкость 0,523 кдж/ ( кг × К) [0,1248 кал/ ( г ×°С)]; удельное электросопротивление 42,1×10 -6 ом × см при 20 °С; температурный коэффициент электросопротивления 0,0035 при 20 °С; обладает сверхпроводимостью ниже 0,38±0,01 К. Т. парамагнитен, удельная магнитная восприимчивость (3,2±0,4)×10 -6при 20°С. Предел прочности 256 Мн/м 2(25,6 кгс/мм 2) , относительное удлинение 72%, твёрдость по Бринеллю менее 1000 Мн/м 2(100 кгс/мм 2) . Модуль нормальной упругости 108000 Мн/м 2(10800 кгс/мм 2) . Металл высокой степени чистоты ковок при обычной температуре.
Применяемый в промышленности технический Т. содержит примеси кислорода, азота, железа, кремния и углерода, повышающие его прочность, снижающие пластичность и влияющие на температуру полиморфного превращения, которое происходит в интервале 865—920 °С. Для технического Т. марок ВТ1-00 и ВТ1-0 плотность около 4,32 г/см 3 , предел прочности 300— 550 Мн/м 2(30—55 кгс/мм 2) , относительное удлинение не ниже 25%, твёрдость по Бринеллю 1150—1650 Мн/м 2(115—165 кгс/мм 2) . Конфигурация внешней электронной оболочки атома Ti 3 d 24 s 2.
Химические свойства. Чистый Т. — химически активный переходный элемент, в соединениях имеет степени окисления + 4, реже +3 и +2. При обычной температуре и вплоть до 500—550 °С коррозионно устойчив, что объясняется наличием на его поверхности тонкой, но прочной окисной плёнки.
С кислородом воздуха заметно взаимодействует при температуре выше 600 °С с образованием TiO 2(см. также Титана окислы ) . Тонкая титановая стружка при недостаточной смазке может загораться в процессе механической обработки. При достаточной концентрации кислорода в окружающей среде и повреждении окисной плёнки путём удара или трения возможно загорание металла при комнатной температуре и в сравнительно крупных кусках.
Окисная плёнка не защищает Т. в жидком состоянии от дальнейшего взаимодействия с кислородом (в отличие, например, от алюминия), и поэтому его плавка и сварка должны проводиться в вакууме, в атмосфере нейтрального газа или под флюсом. Т. обладает способностью поглощать атмосферные газы и водород, образуя хрупкие сплавы, непригодные для практического использования; при наличии активированной поверхности поглощение водорода происходит уже при комнатной температуре с небольшой скоростью, которая значительно возрастает при 400 °С и выше. Растворимость водорода в Т. является обратимой, и этот газ можно удалить почти полностью отжигом в вакууме. С азотом Т. реагирует при температуре выше 700 °С, причём получаются нитриды типа TiN; в виде тонкого порошка или проволоки Т. может гореть в атмосфере азота. Скорость диффузии азота и кислорода в Т. значительно ниже, чем водорода. Получаемый в результате взаимодействия с этими газами слой отличается повышенными твёрдостью и хрупкостью и должен удаляться с поверхности титановых изделий путём травления или механической обработки. Т. энергично взаимодействует с сухими галогенами (см. Титана галогениды ) , по отношению к влажным галогенам устойчив, так как влага играет роль ингибитора.
Металл устойчив в азотной кислоте всех концентраций (за исключением красной дымящейся, вызывающей коррозионное растрескивание Т., причём реакция иногда идёт со взрывом), в слабых растворах серной кислоты (до 5% по массе). Соляная, плавиковая, концентрированная серная, а также горячие органические кислоты: щавелевая, муравьиная и трихлоруксусная реагируют с Т.
Т. коррозионно устойчив в атмосферном воздухе, морской воде и морской атмосфере, во влажном хлоре, хлорной воде, горячих и холодных растворах хлоридов, в различных технологических растворах и реагентах, применяемых в химической, нефтяной, бумагоделательной и др. отраслях промышленности, а также в гидрометаллургии. Т. образует с С, В, Se, Si металлоподобные соединения, отличающиеся тугоплавкостью и высокой твёрдостью. Карбид TiG ( t пл3140 °С) получают нагреванием смеси TiO 2с сажей при 1900—2000 °С в атмосфере водорода; нитрид TiN ( t пл2950 °С) — нагреванием порошка Т. в азоте при температуре выше 700 °С. Известны силициды TiSi 2, Ti 5Si 3, TiSi и бориды TiB, Ti 2B 5, TiB 2. При температурах 400—600 °С Т. поглощает водород с образованием твёрдых растворов и гидридов (TiH, TiH 2). При сплавлении TiO 2со щелочами образуются соли титановых кислот мета- и ортотитанаты (например, Na 2TiO 3и Na 4TiO 4), а также полититанаты (например, Na 2Ti 2O 5и Na 2Ti 3O 7). К титанатам относятся важнейшие минералы Т., например ильменит FeTiO 3, перовскит CaTiO 3. Все титанаты малорастворимы в воде. Двуокись Т., титановые кислоты (осадки), а также титанаты растворяются в серной кислоте с образованием растворов, содержащих титанилсульфат TiOSO 4. При разбавлении и нагревании растворов в результате гидролиза осаждается H 2TiO 3, из которой получают двуокись Т. При добавлении перекиси водорода в кислые растворы, содержащие соединения Ti (IV), образуются перекисные (надтитановые) кислоты состава H 4TiO 5и H 4TiO 8и соответствующие им соли; эти соединения окрашены в жёлтый или оранжево-красный цвет (в зависимости от концентрации Т.), что используется для аналитического определения Т.
Получение. Наиболее распространённым методом получения металлического Т. является магниетермический метод, то есть восстановление тетрахлорида Т. металлическим магнием (реже — натрием):
TiCl 4+ 2Mg = Ti + 2MgCl 2.
В обоих случаях исходным сырьём служат окисные руды Т. — рутил, ильменит и др. В случае руд типа ильменитов Т. в форме шлака отделяется от железа путём плавки в электропечах. Шлак (так же, как рутил) подвергают хлорированию в присутствии углерода с образованием тетрахлорида Т., который после очистки поступает в восстановительный реактор с нейтральной атмосферой.
Читать дальшеИнтервал:
Закладка:
