БСЭ БСЭ - Большая Советская Энциклопедия (ФО)
- Название:Большая Советская Энциклопедия (ФО)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ФО) краткое содержание
Большая Советская Энциклопедия (ФО) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Добыча Ф. р. ведётся открытым и подземным способами; рыхлые фосфориты (например, в Прибалтике) разрабатываются геотехнологическим методом (см. Геотехнология ) .
Способы обогащения Ф. р. разнообразны; выбор их зависит от минерального состава и структурно-текстурных особенностей Ф. р. Апатитовые руды (например, Хибинских месторождений) обогащаются флотацией, дающей богатый апатитовый концентрат (39,4% P 2O 5) при высоком извлечении. Фосфориты (например, Егорьевского, Чилисайского, Вятско-Камского месторождений в СССР, Флориды, Северной Каролины в США и др.) обогащаются промывкой на грохотах; получающийся «первичный» концентрат обычно подвергается дальнейшему обогащению флотацией, магнитной сепарацией, кальцинирующим обжигом; последний способ получает всё большее применение. Некоторые Ф. р. используются без предварительного обогащения, как, например, при электротермическом получении жёлтого фосфора и термической фосфорной кислоты.
Общие запасы Ф. р. мира (без социалистических стран) в 1974 оценивались в 81 млрд. т (или около 18–19 млрд. т P 2O 5); большая их часть сосредоточена в Марокко – 40 млрд. т (см. Фосфоритовые месторождения Северной Африки ) и США – 14,75 млрд. т (см. Фосфоритовые месторождения Северной Америки ); значительные запасы имеются также в Австралии (2,5 млрд. т ) , Тунисе (1,2 млрд. т ) , Зап. Сахаре (3,0 млрд. т ) , Перу (1,5 млрд. т ) и Алжире (1,0 млрд. т ) .
Разведанные запасы Ф. р. в СССР (1976) составляли 10,3 млрд. т (или 1,3 млрд. т P 2O 5) , в том числе апатитов 5,4 млрд. т (0,6 млрд. т P 2O 5), фосфоритов 4,9 млрд. т (0,7 млрд. т P 2O 5). Крупные месторождения Ф. р. известны в МНР (Хубсугульское), Вьетнаме (Лаокай), Китае.
Мировая годовая добыча Ф. р. составляла в 1974 110,8 млн. т, в том числе в США 41,5 млн. т, Марокко 19,7 млн. т, Тунисе 3,9 млн. т, Того 2,6 млн. т, Сенегале 1,9 млн. т, Иордании 1,6 млн. т, ЮАР 1,5 млн. т.
Лит.: Гиммельфарб Б. М., Закономерности размещения месторождений фосфоритов СССР и их генетическая классификация, М., 1965; Бушинский Г. И., Древние фосфориты Азии и их генезис, М., 1966: Арсеньев А. А., Вировлянский Г. М., Смирнов Ф. Л., Генетические типы промышленных месторождений апатита, М., 1971; Научные основы прогноза и поисков фосфоритов, М., 1975; Вещественный состав фосфоритных руд, М., 1975.
А. С. Соколов.
Фосфатный картель
Фосфа'тный карте'ль,см. в ст. Картель международный.
Фосфатшлаки
Фосфатшла'ки,щелочное фосфорное удобрение, побочный продукт при выплавке стали из чугуна при мартеновском производстве. Тёмный тяжёлый порошок, нерастворим в воде, не слёживается. Содержит 16–19% P 2O 5в виде силикофосфата (4CaO×P 2O 5×CaSiO 3) в усваиваемой растениями форме, 26–41% CaO, 4–12% MgO. Наиболее пригоден для кислых почв в качестве основного удобрения под все с.-х. культуры. В СССР Ф. применяют на небольших площадях.
Фосфаты
Фосфа'ты,соли и эфиры фосфорных кислот. Из солей различают ортофосфаты и полимерные (или конденсированные) Ф. Последние делят на полифосфаты, имеющие линейное строение фосфат-анионов, метафосфаты с кольцеобразным (циклическим) фосфат-анионом и ультрафосфаты с сетчатой, разветвленной структурой фосфат-аниона. К Ф. относят также весьма стойкие соединения – фосфаты бора BPO 4и алюминия AlPO 4(хотя правильнее было бы считать их смешанными ангидридами P 2O 5и B 2O 3; P 2O 5и Al 2O 3).
Ортофосфаты – соли ортофосфорной кислоты H 3PO 4– известны одно-, двух- и трёхзамещённые. Однозамещённые ортофосфаты, содержащие анион H 2PO 4, растворимы в воде, из двух- и трёхзамещённых ортофосфатов, содержащих соответственно анионы HPO 4 2-и PO 4 3-, растворимы только соли щелочных металлов и аммония. Трёхзамещённые ортофосфаты, за исключением триаммоний фосфата (NH 4) 3PO 4×3H 2O, термически устойчивы; трикальцийфосфат заметно диссоциирует лишь при температурах выше 2000 °С (диссоциация улучшается под вакуумом): Ca 3(PO 4) 2= 3CaO + P 2O 5. При нагревании одно- и двухзамещённых ортофосфатов происходит их дегидратация с выделением структурной воды и образованием полимерных (линейных или кольцевых) фосфатов по схеме:
( n -2) MeH 2PO 4(2Me 2HPO 4(Me n + 2P n O 3 n + 1+ ( n -1) H 2O
(где n – степень полимеризации).
Все встречающиеся в природе соединения фосфора представляют собой ортофосфаты (см. Фосфаты природные ) . В промышленности растворимые в воде ортофосфаты получают по следующей схеме: 1) производство из природных Ф. (главным образом апатитов ) ортофосфорной кислоты (см. Фосфорные кислоты ) ; 2) взаимодействие ортофосфорной кислоты с гидроокисями, аммиаком, хлоридами или карбонатами, например:
H 3PO 4+ MH 3= NH 4H 2PO 4
H 3PO 4+ KCl = KH 2PO 4– HCl
Труднорастворимые ортофосфаты тяжелых металлов (например, Ag, Cu) образуются в результате обменных реакций, например:
2Na 2HPO 4+ 3AgNO 3= Ag 3PO 4+ 3NaNO 3+ NaH 2PO 4
Полимерные Ф. различных структурных типов могут быть описаны формулами: линейные полифосфаты Me n + 2P n O 3 n + 1, или
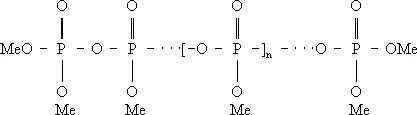
кольцевые метафосфаты Me n P n O 3 n , или
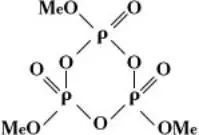
(где n – степень полимеризации).
Свойства полимерных Ф. зависят от характера катиона, строения фосфат-аниона, степени полимеризации, структуры фосфата и др. Так, например, растворимость линейных полифосфатов, как правило, падает с увеличением степени полимеризации, но может быть увеличена путём модифицирования полифосфатов, например изменением скорости охлаждения расплава.
Получают полимерные Ф. (линейные и кольцевые) в основном термической дегидратацией одно- и двухзамещённых ортофосфатов или нейтрализацией соответствующих поли- или мета- (циклических) фосфорных кислот:
H n + 2P n O 3 n + 1+ nN H 3= (NH 4) n H 2P n O 3 n + 1
(иногда эти процессы совмещаются, как, например, при высокотемпературной аммонизации ортофосфорной кислоты для получения полифосфатов аммония). В промышленных масштабах эти способы используют для получения пиро-, триполифосфатов натрия (соответственно Na 4P 2O 7, Na 5P 3O 10) и в меньшей степени – калия, а также полимерных метафосфатов (натрий-фосфатные стекла, метафосфат калия и др.).
Из циклических метафосфатов наиболее изучены тримета-, тетрамета-, гексамета- и октаметафосфаты.
Ультрафосфаты – соединения общей формулы Me nR P n O n (5 + R )/2, где R = Me 2O/P 2O 5, как правило, аморфные, стеклообразные вещества, гигроскопичные, легко гидролизующиеся на воздухе с образованием поли- и метафосфатов. Последние в присутствии большого количества воды могут гидролизоваться за счёт полного расщепления Р–О–Р-связей вплоть до ортофосфатов. Выделенные в кристаллическом виде ультрафосфаты кальция, магния, марганца и некоторых лантаноидов, как правило, не гигроскопичны. Ультрафосфаты образуются в результате термической дегидратации смеси ортофосфатов с фосфорными кислотами или с фосфорным ангидридом, т. е. при наличии условия
Читать дальшеИнтервал:
Закладка:
