БСЭ БСЭ - Большая Советская Энциклопедия (ФТ)
- Название:Большая Советская Энциклопедия (ФТ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ФТ) краткое содержание
Большая Советская Энциклопедия (ФТ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Лит.: Рысс И. Г., Химия фтора и его неорганических соединений, М., 1956; Фтор и его соединения, пер. с англ., т. 1—2, М., 1953—56; Профессиональные болезни, 3 изд., М., 1973.
Фториды
Фтори'ды,соединения фтора с другими элементами. Ф. элементов I и II групп преиодической системы Менделеева — твердые вещества с ионной связью элемент — фтор; Ф. большинства элементов VI—VII групп — газы с ковалентной связью элемент — фтор; соединения, содержащие связь C—F, образуют многочисленный класс фторорганических соединений ; высшие Ф. многих металлов (U, V, Mo, W, Re и др.) — летучие вещества. Ф. встречаются в природе (см. Фториды природные ). По химическим свойствам Ф. галогенов, инертных газов, кислорода и азота, а также многих др. элементов в высших степенях окисления (например, PtF 5, CoF 3, AgF 2) — окислители; Ф. мышьяка, сурьмы, бора — сильные льюисовские кислоты (см. Кислоты и основания ).
Получить Ф. можно взаимодействием фтора с элементами, действием фтористого водорода на металлы и другими способами.
Широкое применение находят фтористый водород, фториды кислорода, фториды азота. Ф. хлора ClF 3и ClF 5— окислители ракетных топлив; кроме того, ClF 3служит фторирующим агентом для получения гексафторида урана UF 6, применяемого в атомной промышленности для изотопов разделения урана; летучие Ф. металлов используются для нанесения металлических покрытий. Ф. лития, магния, кальция, стронция, бария и др. металллов применяют в качестве сырья для производства оптических стёкол. См. также Криолит .
Лит. см. при ст. Фтор .
А. В. Пакратов.
Фториды азота
Фтори'ды азо'та,неорганические соединения, содержащие связь N—F, например трифторид азота NF 3, тетрафторгидразин N 2F 4, дифторамин NF 2H, фтористый нитрозил FNO и др. Ф. а. — бесцветные газы со специфическим запахом. При нагревании разлагаются на элементы или трифторид азота и азот (за исключением NF 3и FNO). Проявляют свойства сильных окислителей. С органическими соединениями некоторые Ф. а. образуют многочисленные органические вещества, содержащие группы —NF 2и —NONF. Особенность Ф. а. состоит в том, что при взаимодействии с сильными льюисовскими кислотами (см. Кислоты и основания ) они образуют соли с фторазотными катионами 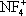 ,
, 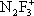 ,
, 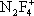 , F 2NO +.
, F 2NO +.
Трифторид азота, NF 3— газ; t пл— 208,5°С, t kип— 129,1°С. Окислительная способность проявляется при высоких температурах. Превращается в тетрафторгидразин при повышенных температурах и в присутствии меди, железа, ртути или угля. Получается электролизом расплава дифторида аммония или фторированием азотсодержащих веществ. Применяется в производстве тетрафторгидразина.
Тетрафторгидразин, N 2F 4— газ; t пл— 161,5°С, t kип— 74,2°С. Способен к диссоциации: N 2F 4Û 2NF 2. При 150°С и давлении 0,1 Мн/м 2 (1 кгс/см 2 ) степень диссоциации 0,2. Диссоциация N 2F 4обусловливает его дифтораминирующее действие, которое проявляется, например, в присоединении к олефинам:
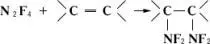 . Тетрафторгидразин получается конверсией трифторида азота над углём (промышленный метод), разложением NF 2H или окислением его растворов. Применяется для синтеза органических дифтораминосоединений.
. Тетрафторгидразин получается конверсией трифторида азота над углём (промышленный метод), разложением NF 2H или окислением его растворов. Применяется для синтеза органических дифтораминосоединений.
Дифторамин, NF 2H — газ; t пл— 116°С, t kип— 23°С. Взрывается при ударе (особенно в жидком и твёрдом состояниях). Проявляет амфотерные свойства. В реакциях действует как дифтораминирующий агент. Получается действием серной кислоты на дифтораминомочевину (продукт фторирования мочевины) или на трифенилметил дифторамин, синтезируемый из N 2F 4и трифенилметилхлорида в присутствии ртути. Применяется для синтеза органических дифтораминосоединений.
Лит.: Панкратов А. В., Химия фторидов азота, М., 1973.
А. В. Панкратов.
Фториды галогенов
Фтори'ды галоге'нов,соединения фтора с др. галогенами. Известны следующие Ф. г.: CIF, CIF 3, CIF 5, BrF, BrF 3, BrF 5, IF, IF 5и IF 7. Подробно см. в ст. Межгалогенные соединения .
Фториды кислорода
Фтори'ды кислоро'да,соединения, содержащие связь О—F, например дифторид OF 2, монофторид (диоксофторид) O 2F 2, нитрат фтора FNO 3, перхлорат фтора FClO 4. Фтор с кислородом образует в тлеющем разряде смесь стабильных радикалов F—O—O и атомов фтора; при конденсации этой смеси при —96°С образуются высшие фториды кислорода — O 2F 2, O 3F 2и др., стабильные лишь при низких температурах.
Все Ф. к. обладают сильной окислительной способностью.
Дифторид кислорода, OF 2— бесцветный газ с резким специфическим запахом, сильно токсичен; плотность 1,521 г/см 3 при — 145°С, t пл— 224°С, t kип— 145°С. OFa медленно разлагается на элементы при температуре около 200°С. Чистый дифторид кислорода не взрывается. Слабо растворяется в воде, подвергаясь гидролизу. Жидкий OF 2неограниченно растворим в жидких фторе, кислороде и озоне. По химическим свойствам OF 2— сильный окислитель; он фторирует металлы при слабом нагревании; с водой, водородом, галогенами реагирует со взрывом при инициировании искрой или при нагревании. OF 2получается фторированием водного раствора едких натра или кали: 2F 2+ 2NaOH = OF 2+ 2NaF + H 2O, а также электролизом водного раствора HF.
Монофторид кислорода, диоксофторид, оксид фтора, O 2F 2— соединение нестабильно. При взаимодействии с льюисовскими кислотами (см. Кислоты и основания ) образует соли диоксигенильного катиона O 2 +, например: O 2F 2+ SbF 5= O 2SbF 6+ 1/ 2F 2. Получают из смеси фтора с кислородом в тлеющем разряде при температуре — 196°С. Применяют в лаборатории как сильный фторирующий и окисляющий агент.
Лит. см. при ст. Фтор .
А. В. Панкратов.
Фториды природные
Фтори'ды приро'дные,класс минералов, природные соединения элементов Na, К, Ca, Mg, Al, редкоземельных элементов (TR), реже Cs, Sr, Pb, Bi, В с фтором. Известно около 35 Ф. п. Различают простые Ф. п.: группа виллиомита — NaF, флюорита — CaF 2, селлаита — MgF 2, флюоцерита — (Ce, La) F 3, и комплексные, в которых комплексообразователями являются В, Al, Mg, TR, Si, а роль адденда выполняет фтор: группа авогадрита — (К, CS)[BF 4], криолита — Na 3[AlF 6], гагаринита — NaCa [TRF 6], нейборита — Na [MgF 6], веберита — Na 2[MgAlF 7], томсенолита — NaCa [AlF 6]·H 2O, малладрита — Na 2SiF 6] и др. Наиболее распространён в природе флюорит .
Ф. п. бесцветны или окрашены в светлые тона, прозрачные или просвечивающие, со стеклянным блеском, низкой твёрдостью (2—5 по минералогической шкале), плотностью (2000—3180 кг/м 3 исключение составляют фториды редких земель) и весьма низкими показателями преломления (1,30—1,50; у флюоцерита 1,61).
Читать дальшеИнтервал:
Закладка:
