БСЭ БСЭ - Большая Советская Энциклопедия (ФТ)
- Название:Большая Советская Энциклопедия (ФТ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ФТ) краткое содержание
Большая Советская Энциклопедия (ФТ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
В СССР Ф. выпускают под название фторлон: политетрафторэтилен — фторлон-4, политрифторхлорэтилен — фторлон-3, в США — под название тефлон и кель-F соответственно.
Лит.: Фторполимеры, пер, с англ., М., 1975; Энциклопедия полимеров, т. 3, М., 1977.
С. В. Соколов.
Фторорганические соединения
Фтороргани'ческие соедине'ния,органическое соединения, содержащие в молекулах одну или несколько связей F—C. Химия Ф. с. начала интенсивно развиваться лишь со 2-й половины 20 в., но уже выросла в большую специализированную область органической химии . Её развитие было обусловлено потребностями молодой атомной промышленности в материалах, стойких к фторирующему действию UF 6, который применяется для изотопов разделения урана. Известны фторпроизводные всех типов органических соединений.
Номенклатура.Положение атома фтора в Ф. с. обозначают согласно правилам номенклатуры органических соединений (см. Номенклатура химическая ). Для построения название полифторзамещённых соединений удобнее пользоваться приставкой «пер». Так, полностью фторировнные углеводороды называются перфторуглеводородами (или фторуглеродами), например CF 3(CF 2) 5CF 3называется перфторгептаном. Частично фторированные соединения можно рассматривать как производные перфторуглеводородов, например CF 3CFH (CF 2) CF 2H называется 1,6-дигидроперфторгептаном. Очень часто в название Ф. с. сочетание «перфтор» заменяют греческой буквой j; в этом случае, например, перфторэтан называется j-этаном. Для обозначения полностью фторированных углеводородов используют также частицу «фор» (фтор), которую включают в наименование соответствующего углеводорода, например название CF 4— метфоран, C 2F 6— этфоран.
Методы синтеза.Прямое фторирование, а также присоединение F 2по двойной связи — радикальные чрезвычайно экзотермические реакции:
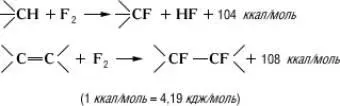
(1 ккал/моль = 4,19 кдж/моль )
Т. к. тепловой эффект фторирования больше, чем разрыва С—С-связей (80—85 ккал/моль ), возможна деструкция фторируемых соединений. Во избежание этого необходим эффективный отвод тепла и разбавление смеси реагирующих веществ азотом. Для отвода тепла в реакционное пространство (трубка) вводят медную сетку или медные стружки, покрытые Ag, Co, Ni или др.; на поверхности сетки (стружек) образуются высшие фториды металлов, которые и служат фторирующими агентами, роль фтора при этом сводится, по-видимому, к их регенерации.
В металлофторидном процессе пары фторируемого вещества, сильно разбавленные азотом, пропускают через трубку с CoF 3:
1/ 2(—CH 2—) + 2CoF з® 1/ 2(—CF 2—) + HF+ 2CoF 2+ 46 ккал/моль .
Образующийся CoF 3действием фтора при 250°С превращают опять в CoF 3. Выходы перфторуглеводородов 80—85%.
Важен метод электрохимического фторирования. Электролитом служит раствор фторируемого вещества в безводном фтористом водороде. В случае неэлектропроводных соединений обычно добавляют KF. Этим методом j-амины, j-окиси и др. Все рассмотренные выше процессы применяются в промышленности.
Обмен атомов хлора на фтор — важный промышленный метод введения фтора (см. Свартса реакция ); может быть произведён безводным HF или фторидами (например, NH 4F, KF, CbF 3Cl 2, AgF 2, HgF 2. Лёгкость обмена зависит от строения хлорсодержащего соединения. Так, хлорангидриды кислот часто легко превращаются во фторангидриды путём растворения их в безводном HF. Атомы Cl в этиленхлоргидрине, хлоруксусной кислоте и её производных легко обмениваются на F при реакции с KF в полярных растворителях (например, этиленгликоле); в моногалогенуглеводородах — лишь действием AgF 2или HgF 2при 150°С. Легче замещаются на фтор атомы хлора в соединениях, содержащих трихлорметильную группу. В промышленности для такого обмена применяют обычно растворы SbF 3или SbF 3Cl 2в безводном HF. Этим способом из хлороформа CHCl 3получают дифторхлорметан, используемый для производства тетрафторэтилена, из CCl 4— дифтордихлорметан (один из важнейших фреонов ), из C 2Cl 6— трифтортрихлорэтан (исходное вещество для производства трифторхлорэтилена).
Сравнительно легко на фтор обмениваются атомы хлора в гексахлорбензоле (действием KF при 450—530°С); C 6F 6и C 6F 5Cl при этом получаются с хорошими выходами. Аналогично реагируют и др. полихлорароматические и полихлоргетероциклические соединения.
Диазометод получения фторароматических соединений основан на образовании борфторида выделяют в твёрдом при нагревании:
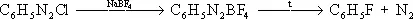
Замена кислородсодержащих группировок в различных органических соединениях на фтор при помощи SF 4(например, в спиртах, альдегидах, кетонах, кислотах):
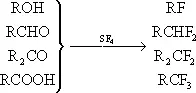
(R — органический остаток).
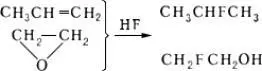
Присоединение безводного фтористого водорода к олефинам, галогенолефинам, окисям, изоцианатам, циклопарафинам и др., например:
Сопряжённое присоединение фтора и др. атомов или групп к соединениям, содержащим кратные связи, легко происходит в избытке безводного HF, например фторнитрование:
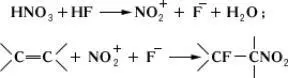
Методы получения фторолефинов. Дегалогенирование вицинальных дигалогенполифторалканов металлами (Zn, Mg и др.), например:
CF 2Cl — CF 2Cl + Zn ® CF 2= CF 2+ ZnCl 2.
Пиролиз политетрафторэтилена, приводящий к образованию перфторпропилена и перфторизобутилена наряду с тетрафторэтиленом, перфторбутиленом, фторциклобутаном и др.:
[—CF 2—] n ® CF 3F = CF 2+ (CF 3) 2C = CF 2+ CF 2= CF 2+ CF 3CF 2CF = CF 2и др.
В промышленности этим способом (а также пиролизом тетрафторэтилена) получают перфторпропилен — важный мономер для производства фторкаучуков.
Пиролиз солей j-карбоновых кислот, например:
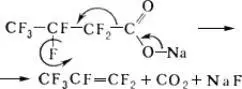
Фторированные спирты получают обычными методами синтеза спиртов , например восстановлением эфиров j-карбоновых кислот, фторированных альдегидов и кетонов. Важный промышленный способ их получения — теломеризация тетрафторэтилена метанолом:
n CF 2= CF 2+ CH 3OH ® Н [—CF2CF2—] n СН 2ОН.
Свойства.Физические свойства. Низшие фторуглероды парафинового ряда (общая формула C n F 2 n +2) — газы, начиная с C 5— жидкости, высшие — твёрдые воскообразные соединения. Только первые четыре представителя этого ряда кипят несколько выше соответствующих углеводородных аналогов, все остальные — ниже.
Читать дальшеИнтервал:
Закладка:
