БСЭ БСЭ - Большая Советская Энциклопедия (ХЛ)
- Название:Большая Советская Энциклопедия (ХЛ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ХЛ) краткое содержание
Большая Советская Энциклопедия (ХЛ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
А. А. Каспаров.
Лит.: Якименко Л. М., Производство хлора, каустической соды и неорганических хлорпродуктов, М., 1974; Некрасов Б. В., Основы общей химии, 3 изд., [т.] 1, М., 1973; Вредные вещества в промышленности, под ред. Н. В, Лазарева, 6 изд., т. 2, Л., 1971; Comprehensive inorganic chemistry, ed. J. C. Bailar [a. o.], v. 1—5, Oxf. — [a. o.], 1973.
Хлора окислы
Хло'ра о'кислы,соединения хлора с кислородом: Cl 2O, ClO 2, Cl 2O 6, Cl 2O 7, Cl 2O 8.
Х. окись (оксид хлора, ангидрид хлорноватистой кислоты ) , Cl 2O, жёлто-коричневый газ с резким запахом, похожим на запах хлора; t nл— 121 °С; t kип2 °С. Энергичный окислитель; нестойкое соединение, в обычных условиях медленно разлагается, в концентрированном и сжиженном виде может самопроизвольно взрываться: 2Cl 2O = 2Cl 2+ O 2. Хорошо растворима в воде (в 1 объёме воды около 200 объёмов Cl 2O) и четырёххлористом углероде; при растворении в воде образуется хлорноватистая кислота HClO. Может быть получена взаимодействием хлора со свежеосаждённой сухой окисью ртути: 2HgO + 2Cl 2= HgCl 2+ Cl 2O. В промышленности получают водные растворы окиси хлора хлорированием карбонатов щелочных или щёлочноземельных металлов в воде. Используют окись хлора для производства гипохлорита кальция.
Х. двуокись (диоксид хлора, смешанный ангидрид хлористой кислоты и хлорноватой кислоты ) , ClO 2, желтовато-оранжевый газ с неприятным запахом; t пл— 59 °С; t kип 10 °С. Энергичный окислитель (особенно в кислой среде); в концентрированном виде взрывается; на свету постепенно разлагается, выше 50°C разложение сопровождается взрывом. Хорошо растворима в воде, серной и уксусной кислотах, четырёххлористом углероде. При взаимодействии с щелочными растворами образует хлориты и хлораты. Получают ClO 2частичным восстановлением хлоратов SO 2, щавелевой или соляной кислотами; в малых количествах действием хлора на хлорит натрия:
2NaClO 2+ Cl 2= 2NaCI + 2ClO 2.
Широко используется в виде водного раствора или в газообразном виде в смеси с воздухом для отбелки и стерилизации целлюлозы, тканей, муки. Взаимодействие ClO 2с водными растворами NaOH в присутствии восстановителя используют для промышленного получения хлоритов.
Х. трёхокись (смешанный ангидрид хлорной кислоты и хлорноватой кислоты), Cl 2O 6, дымящая жидкость тёмно-красного цвета; t nл 3,5 °С; t kип203°C; при контакте с легкоокисляющимися веществами взрывается. В кристаллическом состоянии имеет строение перхлората хлорила ClO + 2ClO 4 -. Энергично реагирует с водой. Может быть получена окислением двуокиси хлора озоном или взаимодействием хлоратов с фтором: 2KClO 3+ F 2= 2KF + Cl 2O 6. Cl 2O 6всегда присутствует в продуктах термического разложения хлорной кислоты. Практического применения не находит.
Хлорный ангидрид, Cl 2O 7, бесцветная жидкость; t nл— 93 °С; t kип83°C; при хранении медленно разлагается и окрашивается продуктами распада — низшими окислами хлора. Cl 2O 7, особенно загрязнённый продуктами распада, самопроизвольно взрывается. При комнатной температуре растворяется в четырёххлористом углероде. С водой реагирует с образованием хлорной кислоты. При контакте с йодом взрывается. Cl 2O 7может быть получен обезвоживанием хлорной кислоты фосфорным ангидридом или олеумом, а также при низкотемпературном электролизе концентрированной хлорной кислоты на платиновом аноде. Практического применения не имеет.
Cl 2O 8— промежуточный продукт при электролизе хлорной кислоты и её солей. В индивидуальном состоянии не выделен. Помимо перечисленных кислородных соединений хлора в литературе упоминается Cl 2O 4, отвечающее структуре перхлорита хлора ClOClO 3; может быть получено взаимодействием фторсульфоната хлора и CsClO 4.
Лит. см. при ст. Хлор.
Л. М. Якименко.
Хлоралгидрат
Хлоралгидра'т,лекарственный препарат; см. в ст. Хлоральгидрат.
Хлораль
Хлора'ль,трихлоруксусный альдегид, CCl 3CHO, бесцветная жидкость с резким запахом, t kип 97,75 °С. Х. энергично взаимодействует с водой, спиртом, аммиаком, образуя хорошо кристаллизующиеся продукты (см. Хлоральгидрат ) . Получают хлорированием этилового спирта; используют в производстве инсектицидов, например хлорофоса, 4,4'-дихлордифенил-трихлорэтана (т. н. ДДТ), гербицидов, трихлоруксусной кислоты, хлороформа.
Хлоральгидрат
Хлоральгидра'т,2,2,2-трихлорэтандиол-1,1,ССl 3CH(OH) 2, бесцветные кристаллы, растворимые в воде, спирте и эфире, t nл 53 °С. Получают Х. взаимодействием хлораля с водой. Х. — лекарственный препарат из группы снотворных средств. Обладает также успокаивающим, аналгезирующим и противосудорожным действием. Применяют внутрь (в порошках и таблетках) и в клизмах преимущественно при нарушениях сна, психическом возбуждении, эпилепсии; входит в состав зубных капель «Дента».
Хлораминометрия
Хлораминоме'трия,титриметрический метод определения восстановителей; основан на применении титрованных растворов хлораминов— хлорамина Т или хлорамина Б. Реагенты проявляют окислительные свойства только в присутствии галогенид-ионов. Конечную точку титрования устанавливают визуально с помощью различных индикаторов, потенциометрически или амперометрически с платиновым вращающимся микроэлектродом. Х. используется для определения, напр As (III), Sb (III), Hg (I), Fe (II), I -, азотсодержащих (нитриты), серусодержащих (сероводород и его производные, сульфиты) соединений, альдегидов, кетонов и др. неорганических и органических соединений.
Лит.: Берка А., Вултерин Я., Зыка Я., Новые ред-окс-методы в аналитической химии, М., 1968, с. 61—84.
Хлорамины
Хлорами'ны,хлорпроизводные аммиака (неорганические Х.) и аминов (органические Х.), в молекулах которых атом хлора связан с азотом. О неорганические Х. см. ст. Хлориды азота.
Органические Х.— жидкости или твёрдые вещества, обладающие резким запахом; раздражают верхние дыхательные пути. Например, N-xлордиметиламин (CH 3)2NCl кипит при 46 °С, N, N-дихлорметиламин CH 3KCl 2— при 58—60 °С, N,N-дихлорэтиламин C 2H 5NCl 2и N-xлордиэтиламин (C 2H 5)2NCl — при 91 °С;
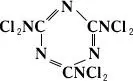 гексахлормеламин — желтоватые кристаллы, t nл 149 °С. Водой (в т. ч. влагой воздуха) Х. разлагаются с образованием амина и хлорноватистой кислоты HOCl; растворы Х. в органических растворителях довольно устойчивы. Получают Х. действием хлора или хлорноватистой кислоты на амины и их соли.
гексахлормеламин — желтоватые кристаллы, t nл 149 °С. Водой (в т. ч. влагой воздуха) Х. разлагаются с образованием амина и хлорноватистой кислоты HOCl; растворы Х. в органических растворителях довольно устойчивы. Получают Х. действием хлора или хлорноватистой кислоты на амины и их соли.
Очень часто название «хлорамины» применяют для обозначения N-xлорпроизводных амидов органических и неорганических кислот. Большое практическое применение нашли хлор- и дихлорамиды ароматических сульфокислот, например т. н. хлорамин Б C 6H 5SO 2NNaCI×3H 2O (натриевая соль N-xлорамида бензолсульфокислоты), хлорамин Т (CH 3)C 6H 4SO 2NNaCI×3H 2O (натриевая соль N-xлорамида n-толуолсульфокислоты) — бесцветные кристаллы, t пл180—185°C и 175—180°C соответственно, хорошо растворимы в воде и спирте; дихлорамин Б (N, N-дихлорбензол-сульфамид) и дихлорамин Т (N,N-дихлор-n-толуолсульфамид) — кристаллы с запахом хлора, t пл 69—72 °С и 80—83 °C соответственно, нерастворимы в воде, растворяются в органических растворителях (обычно используют дихлорэтан).
Читать дальшеИнтервал:
Закладка:
