БСЭ БСЭ - Большая Советская Энциклопедия (ХЛ)
- Название:Большая Советская Энциклопедия (ХЛ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ХЛ) краткое содержание
Большая Советская Энциклопедия (ХЛ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Лит.: Минералы. Справочник, т. 2, в. 1, М., 1963.
И. В. Островская.
Хлорин
Хлори'н,торговое название поливинилхлоридного волокна, выпускаемого в СССР.
Хлорирование (в цветной металлургии)
Хлори'рованиев цветной металлургии, технологический процесс нагрева материалов, содержащих цветные металлы, в атмосфере хлора, хлорсодержащих газов или в присутствии хлористых солей с целью извлечения и разделения цветных металлов.
В основе процесса лежит взаимодействие окислов или сульфидов металлов с хлором или хлоридом водорода по обратимым реакциям. Окислы, у которых гиббсова энергия этих реакций имеет большие отрицательные значения (PbO, ZnO, Ag 2O и др.), хлорируются при малых концентрациях хлора в газовой среде и в присутствии кислорода; окислы с большими положительными значениями гиббсовой энергии (SiO 2, TiO 2, Al 2O 3) практически не взаимодействуют с газообразным хлором, т.к. даже следы кислорода в газовой среде препятствуют образованию хлоридов. Х. окислов облегчается в присутствии веществ, связывающих свободный кислород и уменьшающих его концентрацию в газовой фазе, например углерода, водорода, сернистого ангидрида. Таким образом, изменяя состав газовой фазы и температуру процесса, можно подобрать условия селективного Х.; в частности, в присутствии кислорода и паров воды можно прохлорировать ряд цветных металлов, оставив в окисленной форме железо, а в восстановительной атмосфере перевести в форму хлоридов окислы железа. В качестве хлорирующих агентов, кроме элементарного хлора и HCl, применяют дешёвые соли — каменную соль (NaCl), сильвинит (KCl×2NaCl), хлорид кальция (CaCl 2) и др. При этом Х., в особенности при использовании малолетучего CaCl 2, идёт преимущественно через разложение соли парами воды с образованием HCl; разложению соли-хлоринатора способствует присутствие SO 2или SO 2, образующих CaSO 4, CaSiO 3и т.п.
Разновидности Х.: хлорирующий обжиг, хлоридовозгонка и сегрегация. Хлорирующий обжиг проводят при относительно низкой температуре, при которой образующиеся хлориды ещё нелетучи. Х. осуществляют в электропечах, печах кипящего слоя, трубчатых или многоподовых обжиговых печах. Процесс применяется в производстве магния для перевода окиси магния в хлорид, который затем подвергают электролизу, а также для извлечения кобальта и меди из бедных материалов, чаще всего из пиритных огарков и кобальт-никелевых штейнов; кобальт, медь, цинк переходят в форму хлоридов и выщелачиваются водой или слабой кислотой, а железо не хлорируется и остаётся в форме окислов в твёрдом остатке. Хлоридовозгонка, в отличие от хлорирующего обжига, ведётся при более высоких температурах, обеспечивающих улетучивание хлоридов металлов; процесс более универсален: позволяет извлекать больше различных цветных и редких металлов, а также золото и серебро. Сегрегация, в отличие от хлоридовозгонки, требует меньшего расхода хлоринаторов и ведётся при более низкой температуре, но для получения концентрата необходима дополнительная операция — флотация или магнитная сепарация.
Х. применяется также для рафинирования расплавленных металлов от примесей: алюминия — от натрия и кальция, свинца — от цинка, олова — от свинца. Разрабатываются процессы удаления меди и кобальта из никелевого файнштейна хлоридными расплавами.
Лит.: Смирнов В. И., Тихонов А. И., Обжиг медных руд и концентратов, 2 изд., М., 1966; Морозов И. С., Применение хлора в металлургии редких и цветных металлов, М., 1966; Гудима Н. В., Шейн Я. П., Краткий справочник по металлургии цветных металлов, М., 1975.
И. Д. Резник.
Хлорирование воды
Хлори'рование воды',обработка воды хлором и его соединениями. Наиболее распространённый способ обеззараживания питьевой воды ; основан на способности свободного хлора и его соединений угнетать ферментные системы микробов, катализирующие окислительно-восстановительные процессы. Для обеззараживания питьевой воды применяют хлор, двуокись хлора, хлорамин (см. Хлорамины ) и хлорную известь. Необходимая доза препарата устанавливается пробным Х. в.: она определяется хлор-поглощаемостью воды (количество хлора, необходимое для связывания главным образом содержащихся в воде органических соединений). Хлор вводят с избытком (остаточный хлор) с целью уничтожения микробов, попадающих в воду после её хлорирования. Содержание остаточного свободного хлора через 30 мин после Х. в. должно быть не менее 0,3 мг/л. В некоторых случаях проводят двойное Х. в. — до очистки (предварительное Х. в.) и после неё (заключительное Х. в.); при наличии в воде веществ, которые после Х. в. могут придать ей неприятные запах и привкус, воду до хлорирования обрабатывают аммиаком или аммонийными солями.
Х. в. применяют и для обеззараживания питьевой воды в полевых условиях; наиболее надёжен метод суперхлорирования, обеспечивающий избыток активного хлора не менее 10 мг/л при экспозиции не менее 30 мин. Суперхлорирование применяется и для обеззараживания воды в системах централизованного водоснабжения при эпидемиологических показаниях. После суперхлорирования проводится дехлорирование — устранение избыточного хлора физическими или химическими методами.
Х. в. применяют также для обеззараживания сточных вод, воды плавательных бассейнов, обесцвечивания, обезжелезивания производственных вод и пр.
Лит.: Руководство по гигиене водоснабжения, под ред. С. Н. Черкинского, М., 1975.
Хлорирование (химич.)
Хлори'рованиеорганических соединений, процесс прямого замещения в органических соединениях атомов водорода атомами хлора. Х. может быть осуществлено действием свободного хлора или веществами, его генерирующими, например хлористым сульфурилом SO 2Cl 2(см. Сульфурила галогениды ) . Механизм Х. определяется природой органического соединения и условиями реакции. Так, насыщенные углеводороды взаимодействуют с хлором при облучении ультрафиолетовым светом (УФ-облучении) по радикально-цепному механизму:
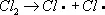 ;
; 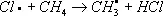 ;
;
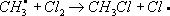 и т. д.
и т. д.
Эта реакция лежит в основе промышленного способа получения из метана метилхлорида, метиленхдорида, хлороформа, четырёххлористого углерода, из пентановых фракций бензина — амилхлоридов. Х. органических соединений ароматического ряда протекает по ионному механизму в присутствии кислотного катализатора, например AlCl 3или FeCl 3. Т. о. в промышленности получают, например, хлорбензол :
Читать дальшеИнтервал:
Закладка:
