БСЭ БСЭ - Большая Советская Энциклопедия (ХЛ)
- Название:Большая Советская Энциклопедия (ХЛ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ХЛ) краткое содержание
Большая Советская Энциклопедия (ХЛ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Cl 2+ FeCl 3® С ++ [FeCl 4] -;
C 6H 6+ Cl +® C 6H 5Cl + Н +;
[FeCl 4] -+ H +® FeCl 3+ HCl.
Принимая во внимание различия в механизмах Х. органических соединений алифатических и ароматических рядов, регулируют Х. жирно-ароматических углеводородов: прибавление FeCl 3ведёт к замещению атомов водорода в ароматическом ядре, тогда как УФ-облучение и повышение температуры способствуют Х. боковых алифатических групп. Так, в промышленности Х. толуола получают хлортолуолы (в присутствии FeCl 3) или бензилхлорид C 6H 5CH 2Cl (под действием УФ-облучения). При высокой температуре удаётся осуществить прямое замещение атомов водорода на хлор и в алкильных группах олефинов (с сохранением кратной связи), например:
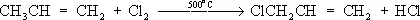
Эта реакция используется в промышленности для получения аллилхлорида— исходного продукта в производстве глицерина.
Иногда под Х. в более широком смысле понимают создание связи С—Cl любым способом, например присоединением по кратным связям хлора, хлористого водорода, хлорноватистой кислоты, хлористого нитрозила, замещением на хлор др. функциональных групп (гидроксильной в спиртах и карбоновых в кислотах, аминогруппы в ароматических аминах после предварительного их диазотирования и др.). Так, в промышленности присоединением хлора к этилену получают дихлорэтан, являющийся сырьём в одном из способов производства винилхлорида ; хлорированием ацетилена — тетрахлорэтан, применяемый для получения трихлорэтилена, хлорированием некоторых каучуков — хлор-каучуки. Реакцией ненасыщенных соединений с хлористым водородом в промышленности производят винилхлорид, этилхлорид, хлоропрен. Х. используется также для получения инсектицидов (гексахлорана, полихлорпинена, полихлоркамфена), гербицидов, например эфиров 2,4-дихлор-феноксиуксусной кислоты, гексахлорэтана (заменителя камфары ) и др. важных продуктов.
Хлорированные полиолефины
Хлори'рованные полиолефи'ны,синтетические полимеры, продукты хлорирования полиэтилена (в СССР называются ХПЭ) и полипропилена (ХПП). Х. п. отличаются разнообразием свойств, зависящих от типа, молекулярной массы и строения исходного полимера, а также от способа введения хлора и его количества. Например, ХПЭ, содержащий до 15% хлора, — пластик; 16—25% — термоэластопласт; 26—48% — эластомер (каучук); 49—60% — жёсткий кожеподобный материал; 61—75% — хрупкая смола. ХПЭ, содержащий 61—70% хлора, приближается по свойствам к поливинилхлориду. Плотность ХПЭ 0,92—1,61 г/см 3 . Прочность при растяжении высокохлорированных ХПЭ и ХПП достигает соответственно 25 и 32 Мн/м 2(250 и 320 кгс/см 2) . Ценные свойства Х. п. — хорошая адгезия к различным поверхностям и огнестойкость. ХПЭ стоек также к действию озона, кислорода, щелочей, растворов солей, сильных кислот, алифатических углеводородов, спиртов, масел, бензина, менее стоек к хлорированным ароматическим углеводородам. При действии света и тепла Х. п. могут отщеплять HCl и поэтому требуют стабилизации (см. Стабилизаторы полимерных материалов ). Из ХПЭ-пластика изготовляют, например, прозрачные плёнки медицинского, бытового и с.-х. назначения. ХПЭ-эластомер применяют в производстве резинотехнических изделий; в смеси с поливинилхлоридом — для получения огне- и морозостойких пластмасс. ХПП перерабатывают в волокна и прозрачные прочные плёнки. ХПЭ и ХПП, содержащие 50—70% хлора, служат связующими лакокрасочных материалов, а также основой клеевых композиций и покрытий различного назначения. Зарубежные торговое название полимеров типа ХПЭ: тирин (США), галофлекс (Великобритания), хлорхостален (ФРГ), эласлен (Япония); полимеров типа ХПП — перлон Р (США). Мировое производство (1976) около 80 тыс. т.
Лит.: Энциклопедия полимеров, т. 3, М., 1977
Г. М. Ронкин.
Хлористая кислота
Хло'ристая кислота',HClO 2, одноосновная кислота, в которой хлор имеет степень окисления +3; существует только в разбавленных водных растворах. Константа диссоциации 1,1×10 -2(18°С). Получается при растворении в воде двуокиси хлора: 2ClO 2+ H 2O = HClO 2+ HClO 3. В промышленности используются соли Х. к. — хлориты, в основном NaClO 2.
Лит. см. при ст. Хлор.
Хлористоводородная кислота
Хлористоводоро'дная кислота',то же, что соляная кислота.
Хлористый водород
Хло'ристый водоро'д,HCl, при обычных условиях бесцветный газ с резким запахом; на воздухе при поглощении влаги образует туман, представляющий собой мельчайшие капельки соляной кислоты. Масса 1 л Х. в. при 0°С и 0,1 Мн/м 2(1 кгс/см 2) 1,6391 г ; плотность по воздуху 1,268; плотность жидкого Х. в при — 60°C 1,12 г/см 3; t пл —114,2°С; t kип—85,1°С. Критические константы: температура 51,4°C; давление 8,45 Мн/м 2 (84,5 кгс/см 2 ); плотность 0,42 г/см 3; удельный объём 2380 см 3 /г. Х. в. растворяется в воде с выделением тепла; при этом образуется соляная кислота. Под давлением 0,1 Мн/м 2(1 кгс /см 2) 1 л воды растворяет 500 л HCl при 2°С, 442 л при 20°C, 339 л при 60°C.
Х. в. — стойкое соединение; при 1800°C он диссоциирует на Cl 2и H 2только в незначительной степени. Химически в отсутствие H 2O Х. в. малоактивен, в газообразном виде не реагирует с углеродом, фосфором, серой, железом. При нагревании с кислородом до 400—500°C в присутствии катализатора CuCl 2Х. в. окисляется до хлора: 4HCl + O 2= 2Н 2О + 2Cl2. Со щелочными металлами, алюминием и магнием реагирует с выделением водорода, особенно легко при нагревании, например: 2Al + 6HCl = 2AlCl 3+ 3Н 2. С аммиаком взаимодействует с образованием дыма — твёрдых частиц хлорида аммония NH 4Cl. В присутствии катализаторов присоединяется к ненасыщенным органическим соединениям, например: C 2H 4+ HCl ® C 2H 5Cl.
Получают Х. в. прямым синтезом из элементов или действием серной кислоты на хлорид натрия. Большие количества Х. в. получаются как побочный продукт при хлорировании органических соединений: RH + Cl 2= RCl + HCl (где R — радикал), а также при гидролизе хлорида магния: MgCl 2+ H 2O = MgO + 2HCl. Мировое производство Х. в. составляет около 10 млн. т (1975).
Х. в. используют для получения соляной кислоты, синтеза органических соединений, например винилхлорида.
Лит.: Якименко Л. М., Производство хлора, каустической соды и неорганических хлорпродуктов, М., 1974; Якименко Л. М., Пасманик М. И., Справочник по производству хлора, каустической соды и основных хлорпродуктов, 2 изд., М., 1976.
Л. М. Якименко.
Хлористый калий
Хло'ристый ка'лий,концентрированное калийное удобрение. Белое кристаллическое вещество, гигроскопично, слёживается при хранении, хорошо растворяется в воде. Содержит калия хлорид и примеси; калия в пересчёте на K 2O — 52—60%. Применяют Х. к. на всех почвах как основное удобрение — осенью под зяблевую вспашку и в пару. При систематическом внесении подкисляет почву (физиологически кислое удобрение). Особенно эффективно при использовании под корнеплоды, картофель, подсолнечник, плодовые и др. калиелюбивые культуры.
Читать дальшеИнтервал:
Закладка:
