БСЭ БСЭ - Большая Советская Энциклопедия (ЦИ)
- Название:Большая Советская Энциклопедия (ЦИ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ЦИ) краткое содержание
Большая Советская Энциклопедия (ЦИ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Цинк (муз. инструмент)
Цинк(нем. Zink), старинный духовой музыкальный инструмент. Прямой или изогнутый рог из дерева или слоновой кости с 6 отверстиями для изменения высоты звуков. В 16—17 вв. использовался в камерной светской и церковной музыке, применялся также (до 19 в.) городскими трубачами в качестве сигнального инструмента.
Цинк (химич. элемент)
Цинк(лат. Zincum), Zn, химический элемент II группы периодической системы Менделеева; атомный номер 30, атомная масса 65,38, синевато-белый металл. Известно 5 стабильных изотопов с массовыми числами 64, 66, 67, 68 и 70; наиболее распространён 64Zn (48,89%). Искусственно получены 9 радиоактивных изотопов, среди которых наиболее долгоживущий 65Zn с периодом полураспада T 1 /2= 245 сут; применяется как изотопный индикатор.
Историческая справка. Сплав Ц. с медью — латунь — был известен ещё древним грекам и египтянам. Чистый Ц. долгое время не удавалось выделить. В 1746 А. С. Маргграф разработал способ получения металла прокаливанием смеси его окиси с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров Ц. в холодильниках. В промышленном масштабе выплавка Ц. началась в 17 в.
Распространение в природе. Среднее содержание Ц. в земной коре (кларк) — 8,3×10 -3% по массе, в основных изверженных породах его несколько больше (1,3×10 -2%) , чем в кислых (6×10 -3%). Известно 66 минералов Ц., важнейшие из них — цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит ZnFe 2O 4. Ц. — энергичный водный мигрант; особенно характерна его миграция в термальных водах вместе с Pb; из этих вод осаждаются сульфиды Ц., имеющие важное промышленное значение (см. Полиметаллические руды ) . Ц. также энергично мигрирует в поверхностных и подземных водах; главным осадителем для него является H 2S, меньшую роль играет сорбция глинами и др. процессы. Ц. — важный биогенный элемент; в живом веществе содержится в среднем 5×10 -4% Ц., но имеются и организмы-концентраторы (например, некоторые фиалки).
Физические и химические свойства. Ц. — металл средней твёрдости. В холодном состоянии хрупок, а при 100—150 °С весьма пластичен и легко прокатывается в листы и фольгу толщиной около сотых долей миллиметра. При 250 °С вновь становится хрупким. Полиморфных модификаций не имеет. Кристаллизуется в гексагональной решётке с параметрами а = 2,6594 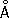 , с = 4,9370
, с = 4,9370 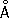 . Атомный радиус 1,37
. Атомный радиус 1,37 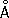 ; ионный Zn 2+— 0,83
; ионный Zn 2+— 0,83 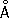 . Плотность твёрдого Ц. 7,133 г/см 3 (20 °С), жидкого 6,66 г/см 3 (419,5 °С); t пл 419,5 °С; t кип 906 °С. Температурный коэффициент линейного расширения 39,7×10 -6(20—250 °С), коэффициент теплопроводности 110,950 вт/ ( м × К ) 0,265 кал/см × сек ×°С (20 °С), удельное электросопротивление 5,9×10 -6 ом × см (20 °С), удельная теплоёмкость Ц. 25,433 кдж/ ( кг ×К) [6,07 кал/г × оС ) ]. Предел прочности при растяжении 200—250 Мн/м 2 (2000—2500 кгс/см 2 ) , относительное удлинение 40—50%, твёрдость по Бринеллю 400—500 Мн/м 2 (4000—5000 кгс/см 2 ). Ц. диамагнитен, его удельная магнитная восприимчивость — 0,175×10 -6.
. Плотность твёрдого Ц. 7,133 г/см 3 (20 °С), жидкого 6,66 г/см 3 (419,5 °С); t пл 419,5 °С; t кип 906 °С. Температурный коэффициент линейного расширения 39,7×10 -6(20—250 °С), коэффициент теплопроводности 110,950 вт/ ( м × К ) 0,265 кал/см × сек ×°С (20 °С), удельное электросопротивление 5,9×10 -6 ом × см (20 °С), удельная теплоёмкость Ц. 25,433 кдж/ ( кг ×К) [6,07 кал/г × оС ) ]. Предел прочности при растяжении 200—250 Мн/м 2 (2000—2500 кгс/см 2 ) , относительное удлинение 40—50%, твёрдость по Бринеллю 400—500 Мн/м 2 (4000—5000 кгс/см 2 ). Ц. диамагнитен, его удельная магнитная восприимчивость — 0,175×10 -6.
Внешняя электронная конфигурация атома Zn 3d 104s 2. Степень окисления в соединениях +2. Нормальный окислительно-восстановительный потенциал, равный 0,76 в, характеризует Ц. как активный металл и энергичный восстановитель. На воздухе при температуре до 100 °С Ц. быстро тускнеет, покрываясь поверхностной плёнкой основных карбонатов. Во влажном воздухе, особенно в присутствии СО 2, происходит разрушение металла даже при обычных температурах. При сильном нагревании на воздухе или в кислороде Ц. интенсивно сгорает голубоватым пламенем с образованием белого дыма цинка окиси ZnO. Сухие фтор, хлор и бром не взаимодействуют с Ц. на холоду, но в присутствии паров воды металл может воспламениться, образуя, например, ZnCl 2. Нагретая смесь порошка Ц. с серой даёт сульфид Ц. ZnS. Сульфид Ц. выпадает в осадок при действии сероводорода на слабокислые или аммиачные водные растворы солей Zn. Гидрид ZnH 2получается при взаимодействии LiAIH 4с Zn (CH 3) 2и др. соединениями Ц.; металлоподобное вещество, разлагающееся при нагревании на элементы. Нитрид Zn 3N 2— чёрный порошок, образуется при нагревании до 600 °С в токе аммиака; на воз духе устойчив до 750 °С, вода его разлагает. Карбид Ц. ZnC 2получен при нагревании Ц. в токе ацетилена. Сильные минеральные кислоты энергично растворяют Ц., особенно при нагревании, с образованием соответствующих солей. При взаимодействии с разбавленными HCl и H 2SO 4выделяется H 2, а с HNO 3— кроме того, NO, NO 2, NH 3. С концентрированными HCl, H 2SO 4и HNO 3Ц. реагирует, выделяя соответственно H 2, SO 2, NO и NO 2. Растворы и расплавы щелочей окисляют Ц. с выделением На и образованием растворимых в воде цинкатов. Интенсивность действия кислот и щелочей на Ц. зависит от наличия в нём примесей. Чистый Ц. менее реакционноспособен по отношению к этим реагентам из-за высокого перенапряжения на нём водорода. В воде соли Ц. при нагревании гидролизуются, выделяя белый осадок гидроокиси Zn (OH) 2(см. Амфотерность ) . Известны комплексные соединения, содержащие Ц., например [Zn (NH 3) 4] SO 4и др.
Получение. Ц. добывают из полиметаллических руд, содержащих 1—4% Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60% Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид Ц. в окись ZnO; образующийся при этом сернистый газ SO 2расходуется на производство серной кислоты. От ZnO к Zn идут двумя путями. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожжённый концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углём или коксом при 1200—1300 °С: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожжённой глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда (см. Огнеупоры ) , затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов Ц. получают в шахтных печах с дутьём. Производительность постепенно повышалась, но Ц. содержал до 3% примесей, в том числе ценный кадмий. Дистилляционный Ц. очищают ликвацией (т. е. отстаиванием жидкого металла от железа и части свинца при 500 °С), достигая чистоты 98,7%. Применяющаяся иногда более сложная и дорогая очистка ректификацией даёт металл чистотой 99,995% и позволяет извлекать кадмий.
Читать дальшеИнтервал:
Закладка:
