БСЭ БСЭ - Большая Советская Энциклопедия (ЦИ)
- Название:Большая Советская Энциклопедия (ЦИ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ЦИ) краткое содержание
Большая Советская Энциклопедия (ЦИ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Лит.: Металлургия циркония, пер. с англ., М., 1959; Труды второй Международной конференции по мирному использованию атомной энергии, Женева, 1958. Доклады советских ученых, т. 3, М., 1959, с. 486; Ривкин Е. Ю., Родченков Б. С., Филатов В. И., Прочность сплавов циркония, М., 1974; Дуглас Д., Металловедение циркония, пер. с англ., М., 1975 (лит.).
А. А. Киселев.
Цирконий
Цирко'ний(лат. Zirconium), Zr, химический элемент IV группы периодической системы Менделеева; атомный номер 40, атомная масса 91,22; серебристо-белый металл с характерным блеском. Известно пять природных изотопов Ц.: 90Zr (51,46%), 91Zr (11,23%), 92Zr (17,11%) 94Zr (17,4%), 96Zr (2,8%). Из искусственных радиоактивных изотопов важнейший 95Zr (T 1/2= 65 сут ) ; используется в качестве изотопного индикатора.
Историческая справка. В 1789 немецкий химик М. Г. Клапрот в результате анализа минерала циркона выделил двуокись Ц. Порошкообразный Ц. впервые был получен в 1824 И. Берцелиусом, а пластичный — в 1925 нидерландскими учёными А. ван Аркелом и И. де Буром при термической диссоциации иодидов Ц.
Распространение в природе. Среднее содержание Ц. в земной коре (кларк) 1,7×10 -2% по массе, в гранитах, песчаниках и глинах несколько больше (2×10 -2%) , чем в основных породах (1,3×10 -2 % ) . Максимальная концентрации Ц. — в щелочных породах (5×10 -2%). Ц. слабо участвует в водной и биогенной миграции. В морской воде содержится 0,00005 мг/л Ц. Известно 27 минералов Ц.; промышленное значение имеют бадделеит ZrO 2, циркон. Основные типы месторождений Ц.: щелочные породы с малаконом и цитролитом; магнетит-форстерит-апатитовые породы и карбонатиты с бадделеитом; прибрежно-морские и элювиально-делювиальные россыпи.
Физические и химические свойства. Ц. существует в двух кристаллических модификациях: a-формы с гексагональной плотноупакованной решёткой ( а = 3,228 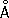 ; с = 5,120
; с = 5,120 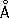 ) и b-формы с кубической объёмноцентрированной решёткой ( а = 3,61
) и b-формы с кубической объёмноцентрированной решёткой ( а = 3,61 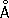 ). Переход a ® b происходит при 862 °C. Плотность a-Ц. (20 °C) 6,45 г/см 3; t пл 1825 ± 10 °C; t кип 3580—3700 °C; удельная теплоёмкость (25—100 °С) 0,291 кдж/ ( кг × К ) [0,0693 кал/ ( г × °С )] , коэффициент теплопроводности (50 °С) 20,96 вт/ ( м × К ) [0,050 кал/ ( см × сек ×°С)]; температурный коэффициент линейного расширения (20—400 °С) 6,9×10 -6; удельное электрическое сопротивление Ц. высокой степени чистоты (20°С) 44,1 мком × см. температура перехода в состояние сверхпроводимости 0,7 К. Ц. парамагнитен; удельная магнитная восприимчивость увеличивается при нагревании и при —73 °С равна 1,28×10 -6, а при 327 °С — 1,41×10 -6. Сечение захвата тепловых нейтронов (0,18 ± 0,004)×10 -28 м 2 , примесь гафния увеличивает это значение. Чистый Ц. пластичен, легко поддаётся холодной и горячей обработке (прокатке, ковке, штамповке). Наличие растворённых в металле малых количеств кислорода, азота, водорода и углерода (или соединений этих элементов с Ц.) вызывает хрупкость Ц. Модуль упругости (20 °С) 97 Гн/м 2 (9700 кгс /мм 2 ) ; предел прочности при растяжении 253 Мн/м 2 (25,3 кгс/мм 2 ) ; твёрдость по Бринеллю 640—670 Мн/м 2 (64—67 кгс/мм 2 ) ; на твёрдость очень сильное влияние оказывает содержание кислорода: при концентрации более 0,2% Ц. не поддаётся холодной обработке давлением.
). Переход a ® b происходит при 862 °C. Плотность a-Ц. (20 °C) 6,45 г/см 3; t пл 1825 ± 10 °C; t кип 3580—3700 °C; удельная теплоёмкость (25—100 °С) 0,291 кдж/ ( кг × К ) [0,0693 кал/ ( г × °С )] , коэффициент теплопроводности (50 °С) 20,96 вт/ ( м × К ) [0,050 кал/ ( см × сек ×°С)]; температурный коэффициент линейного расширения (20—400 °С) 6,9×10 -6; удельное электрическое сопротивление Ц. высокой степени чистоты (20°С) 44,1 мком × см. температура перехода в состояние сверхпроводимости 0,7 К. Ц. парамагнитен; удельная магнитная восприимчивость увеличивается при нагревании и при —73 °С равна 1,28×10 -6, а при 327 °С — 1,41×10 -6. Сечение захвата тепловых нейтронов (0,18 ± 0,004)×10 -28 м 2 , примесь гафния увеличивает это значение. Чистый Ц. пластичен, легко поддаётся холодной и горячей обработке (прокатке, ковке, штамповке). Наличие растворённых в металле малых количеств кислорода, азота, водорода и углерода (или соединений этих элементов с Ц.) вызывает хрупкость Ц. Модуль упругости (20 °С) 97 Гн/м 2 (9700 кгс /мм 2 ) ; предел прочности при растяжении 253 Мн/м 2 (25,3 кгс/мм 2 ) ; твёрдость по Бринеллю 640—670 Мн/м 2 (64—67 кгс/мм 2 ) ; на твёрдость очень сильное влияние оказывает содержание кислорода: при концентрации более 0,2% Ц. не поддаётся холодной обработке давлением.
Внешняя электронная конфигурация атома Zr 4d 25s 2 . Для Ц. характерна степень окисления +4. Более низкие степени окисления +2 и +3 известны для Ц. только в его соединениях с хлором, бромом и йодом. Компактный Ц. медленно начинает окисляться в пределах 200—400 °С, покрываясь плёнкой циркония двуокиси ZrO 2; выше 800 °С энергично взаимодействует с кислородом воздуха. Порошкообразный металл пирофорен — может воспламеняться на воздухе при обычной температуре. Ц. активно поглощает водород уже при 300 °С, образуя твёрдый раствор и гидриды ZrH и ZrH 2; при 1200—1300 °С в вакууме гидриды диссоциируют и весь водород может быть удалён из металла. С азотом Ц. образует при 700—800 °С нитрид ZrN. Ц. взаимодействует с углеродом при температуре выше 900 °С с образованием карбида ZrC. Карбид и нитрид Ц. — твёрдые тугоплавкие соединения; карбид Ц. — полупродукт для получения ZrCl 4. Ц. вступает в реакцию с фтором при обычной температуре, а с хлором, бромом и иодом при температуре выше 200 °С, образуя высшие галогениды ZrX 4(где Х — галоген). Ц. устойчив в воде и водяных парах до 300 °С, не реагирует с соляной и серной (до 50%) кислотами, а также с растворами щелочей (Ц. — единственный металл, стойкий в щелочах, содержащих аммиак). С азотной кислотой и царской водкой взаимодействует при температуре выше 100 °С. Растворяется в плавиковой и горячей концентрированной (выше 50%) серной кислотах. Из кислых растворов могут быть выделены соли соответствующих кислот разного состава, зависящего от концентрации кислоты. Так, из концентрированных сернокислых растворов Ц. осаждается кристаллогидрат Zr (SO 4) 2×4H 2O; из разбавленных растворов — основные сульфаты общей формулы xZrO 2×ySO 3×zH 2O (где х : y > 1). Сульфаты Ц. при 800—900 °С полностью разлагаются с образованием двуокиси Ц. Из азотнокислых растворов кристаллизуется Zr (NO 3) 4×5H 2O или ZrO (NO 3) 2×xH 2O (где х = 2—6), из солянокислых растворов — ZrOCl 2×8H 2O, который обезвоживается при 180—200 °С.
Получение. В СССР основным промышленным источником получения Ц. является минерал циркон ZrSiO 4. Циркониевые руды обогащаются гравитационными методами с очисткой концентратов магнитной и электростатической сепарацией. Металл получают из его соединений, для производства которых концентрат вначале разлагают. Для этого применяют: 1) хлорирование в присутствии угля при 900—1000 °С (иногда с предварительной карбидизацией при 1700—1800 °С для удаления основной части кремния в виде легколетучего SiO); при этом получается ZrCl 4, который возгоняется и улавливается; 2) сплавление с едким натром при 500—600 °С или с содой при 1100 °С: ZrSiO 4+ 2Na 2CO 3= Na 2ZrO 3+ Na 2SiO 3+ 2CO 2; 3) спекание с. известью или карбонатом кальция (с добавкой CaCl 2) при 1100—1200 °С: ZrSiO 4+ 3CaO = CaZrO 3+ Ca 2SiO 4; 4) сплавление с фторосиликатом калия при 900 °С: ZrSiO 4+ K 2SiF 6= K 2ZrF 6+ 2SiO 2. Из спёка или плава, полученного в случаях щелочного вскрытия (2,3), вначале удаляют соединения кремния выщелачиванием водой или разбавленной соляной к той, а затем остаток разлагают соляной или серной; при этом образуются соответственно оксихлорид и сульфаты. Фтороцирконатный спек (4) обрабатывают подкисленной водой при нагревании; при этом в раствор переходит фтороцирконат калия, 75—90% которого выделяется при охлаждении раствора.
Для выделения соединений Ц. из кислых растворов применяют следующие способы: 1) кристаллизацию оксихлорида Ц. ZrOCl 2×8H 2O при выпаривании солянокислых растворов; 2) гидролитическое осаждение основных сульфатов Ц. xZrO 2×ySO 3(zH 2O из сернокислых или солянокислых растворов; 3) кристаллизацию сульфата Ц. Zr (SO 4) 2при добавлении концентрированной серной кислоты или при выпаривании сернокислых растворов. В результате прокаливания сульфатов и хлоридов получают ZrO 2.
Читать дальшеИнтервал:
Закладка:
