БСЭ БСЭ - Большая Советская Энциклопедия (ХР)
- Название:Большая Советская Энциклопедия (ХР)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ХР) краткое содержание
Большая Советская Энциклопедия (ХР) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Хром
Хром(лат. Cromium), Cr, химический элемент VI группы периодической системы Менделеева, атомный номер 24, атомная масса 51,996; металл голубовато-стального цвета.
Природные стабильные изотопы: 50Cr (4,31%), 52Cr (87,76%), 53Cr (9,55%) и 54Cr (2,38%). Из шести искусственных радиоактивных изотопов наиболее важен 51Cr (период полураспада T 1 /2= 27,8 сут ) , который применяется как изотопный индикатор.
Историческая справка. Х. открыт в 1797 Л. Н. Вокленом в минерале крокоите — природном хромате свинца PbCrO 4. Название Х. получил от греческого слова chroma — цвет, краска (из-за разнообразия окраски своих соединений). Независимо от Воклена Х. был открыт в крокоите в 1798 немецким учёным М. Г. Клапротом.
Распространение в природе. Среднее содержание Х. в земной коре (кларк) 8,3×10 -3%. Этот элемент, вероятно, более характерен для мантии Земли, т.к. ультраосновные породы, которые, как полагают, ближе всего по составу к мантии Земли, обогащены Х. (2×10 -1%). Х. образует массивные и вкрапленные руды в ультраосновных горных породах; с ними связано образование крупнейших месторождений Х. (см. Хромовые руды ) . В основных породах содержание Х. достигает лишь 2×10 -2%, в кислых — 2,5×10 -3%, в осадочных породах (песчаниках) — 3,5×10 -3%, глинистых сланцах — 9×10 -3%. Х. — сравнительно слабый водный мигрант; содержание Х. в морской воде 0,00005 мг/л.
В целом Х. — металл глубинных зон Земли; каменные метеориты (аналоги мантии) тоже обогащены Х. (2,7×10 -1%). Известно свыше 20 минералов Х. Промышленное значение имеют только хромшпинелиды (до 54% Cr); кроме того, Х. содержится в ряде др. минералов, которые нередко сопровождают хромовые руды, но сами не представляют практической ценности ( уваровит, волконскоит, кемерит, фуксит).
А. И. Перельман.
Физические и химические свойства. Х. — твёрдый, тяжёлый, тугоплавкий металл. Чистый Х. пластичен. Кристаллизуется в объёмноцентрированной решётке, а = 2 885 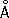 (20 °С); при ~ 1830 °С возможно превращение в модификацию с гранецентрированной решёткой, а = 3,69
(20 °С); при ~ 1830 °С возможно превращение в модификацию с гранецентрированной решёткой, а = 3,69 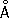 .
.
Атомный радиус 1,27 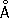 ; ионные радиусы Cr 2+0,83
; ионные радиусы Cr 2+0,83 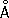 , Cr 3+0,64
, Cr 3+0,64 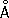 , Cr 6+0,52
, Cr 6+0,52 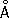 Плотность 7,19 г/см 3 ; t пл 1890 °С; t кип 2480 °С. Удельная теплоёмкость 0,461 кдж/ ( кг × К. ) [0,11 кал/(г ×°С)] (25°С); термический коэффициент линейного расширения 8,24×10 -6(при 20 °С); коэффициент теплопроводности 67 вм/ ( м × К ) [0,16 кал/ ( см × сек × °С )] (20 °С); удельное электросопротивление 0,414 мком × м (20°С); термический коэффициент электросопротивления в интервале 20—600 °С составляет 3,01×10 -3. Х. антиферромагнитен, удельная магнитная восприимчивость 3,6×10 -6. Твёрдость высокочистого Х. по Бринеллю 7—9 Мн/м 2 (70—90 кгс/см 2 ) .
Плотность 7,19 г/см 3 ; t пл 1890 °С; t кип 2480 °С. Удельная теплоёмкость 0,461 кдж/ ( кг × К. ) [0,11 кал/(г ×°С)] (25°С); термический коэффициент линейного расширения 8,24×10 -6(при 20 °С); коэффициент теплопроводности 67 вм/ ( м × К ) [0,16 кал/ ( см × сек × °С )] (20 °С); удельное электросопротивление 0,414 мком × м (20°С); термический коэффициент электросопротивления в интервале 20—600 °С составляет 3,01×10 -3. Х. антиферромагнитен, удельная магнитная восприимчивость 3,6×10 -6. Твёрдость высокочистого Х. по Бринеллю 7—9 Мн/м 2 (70—90 кгс/см 2 ) .
Внешняя электронная конфигурация атома Х. 3d 54s 1 . В соединениях обычно проявляет степени окисления +2, +3, +6, среди них наиболее устойчивы Cr 3+; известны отдельные соединения, в которых Х. имеет степени окисления +1, +4, +5. Х. химически малоактивен. При обычных условиях устойчив к кислороду и влаге, но соединяется с фтором, образуя CrF 3. Выше 600 °С взаимодействует с парами воды, давая Cr 2O 3; азотом — Cr 2N, CrN; углеродом — Cr 23C 6, Cr 7C 3, Cr 3C 2; серой — Cr 2S 3. При сплавлении с бором образует борид CrB, с кремнием — силициды Cr 3Si, Cr 2Si 3, CrSi 2. Со многими металлами Х. даёт сплавы (см. Хромовые сплавы ) . Взаимодействие с кислородом протекает сначала довольно активно, затем резко замедляется благодаря образованию на поверхности металла окисной плёнки. При 1200 °С плёнка разрушается и окисление снова идёт быстро. Х. загорается в кислороде при 2000 °С с образованием темно-зелёной окиси Х. Cr 2O 3. Помимо окиси, известны др. соединения с кислородом, например CrO, CrO 3, получаемые косвенным путём (подробнее см. Хрома окислы ) . Х. легко реагирует с разбавленными растворами соляной и серной кислот с образованием хлорида и сульфата Х. и выделением водорода; царская водка и азотная кислота пассивируют Х.
С увеличением степени окисления возрастают кислотные и окислительные свойства Х. Производные Cr2 +— очень сильные восстановители. Ион Cr 2+образуется на первой стадии растворения Х. в кислотах или при восстановлении Cr 3+в кислом растворе цинком. Гидрат закиси Cr (OH) 2при обезвоживании переходит в CrO 4 2-. Соединения Cr 3+устойчивы на воздухе. Могут быть и восстановителями и окислителями. Cr 3+можно восстановить в кислом растворе цинком до Cr 2+или окислить в щелочном растворе до CrO 4 2- бромом и др. окислителями. Гидроокись Cr (OH) 3(вернее Cr 2O 3×nH 2O — амфотерное соединение, образующее соли с катионом Cr 3+или соли хромистой кислоты HCrO 2— хромиты (например, KCrO 2, NaCrO 2). Соединения Cr 6+: хромовый ангидрид CrO 3, хромовые кислоты и их соли, среди которых наиболее важны хромоты и дихроматы (см. также Хромпик ) — сильные окислители. Х. образует большое число солей с кислородсодержащими кислотами. Известны комплексные соединения Х.; особенно многочисленны комплексные соединения Cr 3+, в которых Х. имеет координационное число 6. Существует значительное число перекисных соединений Х.
Получение. В зависимости от цели использования получают Х. различной степени чистоты. Сырьём обычно служат хромшпинелиды, которые подвергают обогащению, а затем сплавляют с поташом (или содой) в присутствии кислорода воздуха. Применительно к основному компоненту руд, содержащему Cr 3+, реакция следующая:
2FeCr 2O 4+ 4К 2СО 3+ 3,5O 2 = 4K 2CrO 4+ Fe 2O 3+ 4CO 2.
Образующийся хромат калия K 2CrO 4выщелачивают горячей водой и действием H 2SO 4превращают его в дихромат K 2Cr 2O 4 . Далее действием концентрированного раствора H 2SO 4на K 2Cr 2O 7получают хромовый ангидрид CrO 3или нагреванием K 2Cr 2O 7с серой — окись Х. Cr 2O 3.
Наиболее чистый Х. в промышленных условиях получают либо электролизом концентрированных водных растворов CrO 3или Cr 2O 3, содержащих H 2SO 4, либо электролизом сульфата Х. Cr 2(SO 4) 3. При этом Х. выделяется на катоде из алюминия или нержавеющей стали. Полная очистка от примесей достигается обработкой Х. особо чистым водородом при высокой температуре (1500—1700 °С).
Возможно также получение чистого Х. электролизом расплавов CrF 3или CrCl 3в смеси с фторидами натрия, калия, кальция при температуре около 900 °С в атмосфере аргона.
В небольших количествах Х. получают восстановлением Cr 2O 3алюминием или кремнием. При алюминотермическом способе предварительно подогретую шихту из Cr 2O 3и порошка или стружек Al с добавками окислителя загружают в тигель, где реакцию возбуждают поджиганием смеси Na 2O 2и Al до тех пор, пока тигель заполнится Х. и шлаком. Силикотермически Х. выплавляют в дуговых печах. Чистота получаемого Х. определяется содержанием примесей в Cr 3O 3и в Al или Si, используемых для восстановления.
Читать дальшеИнтервал:
Закладка:
