БСЭ БСЭ - Большая Советская Энциклопедия (ЭЛ)
- Название:Большая Советская Энциклопедия (ЭЛ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ЭЛ) краткое содержание
Большая Советская Энциклопедия (ЭЛ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
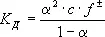 (2)
(2)
где f ± — средний коэффициент активности электролита (см. также Оствальда закон разбавления ) .
Классическая теория Э. д. применима лишь к разбавленным растворам слабых электролитов. Сильные электролиты в разбавленных растворах диссоциированы практически полностью, поэтому представления о равновесии между ионами и недиссоциированными молекулами лишено смысла. Согласно представлениям, выдвинутым в 20—30-х гг. 20 в. В. К. Семенченко (СССР), Н. Бьеррумом (Дания), Р. М. Фуоссом (США) и др., в растворах сильных электролитов при средних и высоких концентрациях образуются ионные пары и более сложные агрегаты. Современные спектроскопические данные показывают, что ионная пара состоит из двух ионов противоположного знака, находящихся в контакте («контактная ионная пара») или разделённых одной или несколькими молекулами растворителя («разделённая ионная пара»). Ионные пары электрически нейтральны и не принимают участия в переносе электричества. В сравнительно разбавленных растворах сильных электролитов равновесие между отдельными сольватированными ионами и ионными парами может быть приближённо охарактеризовано, аналогично классической теории Э. д., константой диссоциации (или обратной величиной — константой ассоциации). Это позволяет использовать уравнение (2) для расчёта соответствующей степени диссоциации, исходя из экспериментальных данных.
В простейших случаях (большие одноатомные однозарядные ионы) приближённые значения константы диссоциации в разбавленных растворах сильных электролитов можно вычислить теоретически, исходя из представлений о чисто электростатическом взаимодействии между ионами в непрерывной среде — растворителе.
Лит.: Измайлов Н. А., Электрохимия растворов, 3 изд., М.,1976; Monk C. В., Electrclytic dissociation, L. — N. Y., 1961.
А. И. Мишустин.
Электролитическая сварка
Электролити'ческая сва'рка,производится при нагреве соединяемых частей постоянным электрическим током напряжением 110—220 в в водном щелочном электролите. Свариваемые части, погруженные в ванну с электролитом, образуют катод, анодом служит металлическая пластина. Э. с. ещё несовершенна и применяется редко, в основном для сварки мелких деталей, проволок и т. п. из различных металлов.
Электролитическая ячейка
Электролити'ческая яче'йка,сосуд с электролитом (электролитами), снабженный электродами, в котором реализуются электрохимические реакции. Основной конструкционный элемент промышленных электролизёров. Как самостоятельный аппарат используется главным образом в лабораторных условиях при изучении электродных процессов, проведении электроаналитических измерений, получении и очистке веществ электролизом. Конструкции Э. я. чрезвычайно разнообразны. В электрохимических работах обычно применяют Э. я. с тремя электродами: рабочим (исследуемым), вспомогательным (поляризующим) и электродом сравнения. Сложные Э. я. могут содержать также электроды индикаторные и др.; специальные Э. я. должны удовлетворять ряду дополнительных требований, например обеспечивать сочетание электрохимических и других физико-химических методов исследования.
Э. я. находят применение при моделировании физическом, в частности, с помощью Э. я. можно моделировать электрические поля электронных устройств, например электронных ламп.
А. Н. Чемоданов.
Электролиты
Электроли'ты(от электро... и греч. lytos — разлагаемый, растворимый), жидкие или твёрдые вещества и системы, в которых присутствуют в сколько-нибудь заметной концентрации ионы, обусловливающие прохождение электрического тока. В узком смысле Э. называются вещества, растворы которых проводят электрический ток ионами, образующимися в результате электролитической диссоциации. Э. в растворах подразделяют на сильные и слабые. Сильные Э. практически полностью диссоциированы на ионы в разбавленных растворах. К ним относятся многие неорганические соли и некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.). Молекулы слабых Э. в растворах лишь частично диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым Э. относится большинство органических кислот и многие органические основания в водных и неводных растворах. Деление Э. на сильные и слабые в некоторой степени условно, т. к. оно отражает не свойства самих Э., а их состояние в растворе. Последнее зависит от концентрации, природы растворителя, температуры, давления и др.
По количеству ионов, на которые диссоциирует в растворе одна молекула, различают бинарные, или одно-одновалентные, Э. (обозначаются 1-1 Э., например КС1), одно-двухвалентные Э. (обозначаются 1-2 Э., например CaCl 2) и т. д. Э. типа 1-1, 2-2, 3-3 и т. п. называются симметричными, типа 1-2, 1-3 и т. п. — несимметричными.
Свойства разбавленных растворов слабых Э. удовлетворительно описываются классической теорией электролитической диссоциации. Для не слишком разбавленных растворов слабых Э., а также для растворов сильных Э. эта теория неприменима, поскольку они являются сложными системами, состоящими из ионов, недиссоциированных молекул или ионных пар, а также более крупных агрегатов. Свойства таких растворов определяются характером взаимодействий ион-ион, ион-растворитель, а также изменением свойств и структуры растворителя под влиянием растворённых частиц. Современные статистические теории сильных Э. удовлетворительно описывают свойства лишь очень разбавленных (<0,1 моль/л ) растворов.
Э. чрезвычайно важны в науке и технике. Все жидкие системы в живых организмах содержат Э. Важный класс Э. — полиэлектролиты . Э. являются средой для проведения многих химических синтезов и процессов электрохимических производств. При этом всё большую роль играют неводные растворы Э. Изучение свойств растворов Э. важно для создания новых химических источников тока и совершенствования технологических процессов разделения веществ — экстракции из растворов и ионного обмена.
Лит. см. при ст. Электролитическая диссоциация.
А. И. Мишустин.
Электролов
Электроло'в,промышленный способ лова рыб, использующий их характерные реакции на протекающий через тело электрический ток. В зависимости от силы тока (постоянного или импульсного) в поведении рыб различают 3 стадии: отпугивание, направленное движение к аноду (т. н. анодная реакция) и электронаркоз. При Э. может использоваться любая из трёх стадий. Границы стадий зависят от вида, размеров и физиологического состояния рыб. Кроме того, реакция рыб разных видов зависит от длительности и частоты импульсов. При Э. ток через тело рыб протекает при попадании их в электрическое поле, возникающее между электродами, находящимися в воде и подключенными к источнику тока. Э. на постоянном токе осуществляется с помощью относительно маломощных электрических генераторов; применяется на пресных водоёмах. В морской воде более перспективен Э. с помощью импульсного тока, т. к. при этом резко сокращается расход электроэнергии. Основные разновидности Э. — лов электрифицированным тралом и бессетевой лов. Для лова донных рыб электроды устанавливают в устьевой части трала, а параметры электрических импульсов подбирают так, чтобы вызвать у рыб анодную реакцию и не дать им уйти под нижнюю подбору трала. При лове рыб, обитающих в толще воды, используют эффект электронаркоза, а электроды устанавливают на предмешковой части трала. Рыбы, попавшие в межэлектродное пространство, наркотизуются и смываются потоком воды в куток, что ускоряет формирование улова. Кроме того, эффективность лова растет за счёт уменьшения выхода рыб из трала. Бессетевым Э. вылавливают рыб, обладающих заметной анодной реакцией. Под влиянием тока они направляются в область действия насосов. Э. с помощью импульсных токов часто используют в сочетании со светоловом. Для повышения эффективности Э. проводятся исследования по выбору параметров электрического поля и его конфигурации, силы тока, частоты следования импульсов и т. д.
Читать дальшеИнтервал:
Закладка:
