Андрей Пенделя - Большой справочник анализов
- Название:Большой справочник анализов
- Автор:
- Жанр:
- Издательство:Array Литагент «Клуб семейного досуга»
- Год:2014
- Город:Белгород
- ISBN:978-966-14-7411-5
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Андрей Пенделя - Большой справочник анализов краткое содержание
Данная книга является частью книги «Большой справочник симптомов / Большой справочник анализов»
Большой справочник анализов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Механизмы трансформации протромбина в тромбин.
Согласно современной каскадно-комплексной теории свертывания крови, активация протромбина (фактора II) является результатом многоступенчатого ферментного процесса, в котором последовательно активируются и взаимодействуют между собой различные факторы свертывания.
Различают два основных механизма запуска процесса свертывания – внешний и внутренний.
Таблица 6. Характеристика факторов свертывания крови
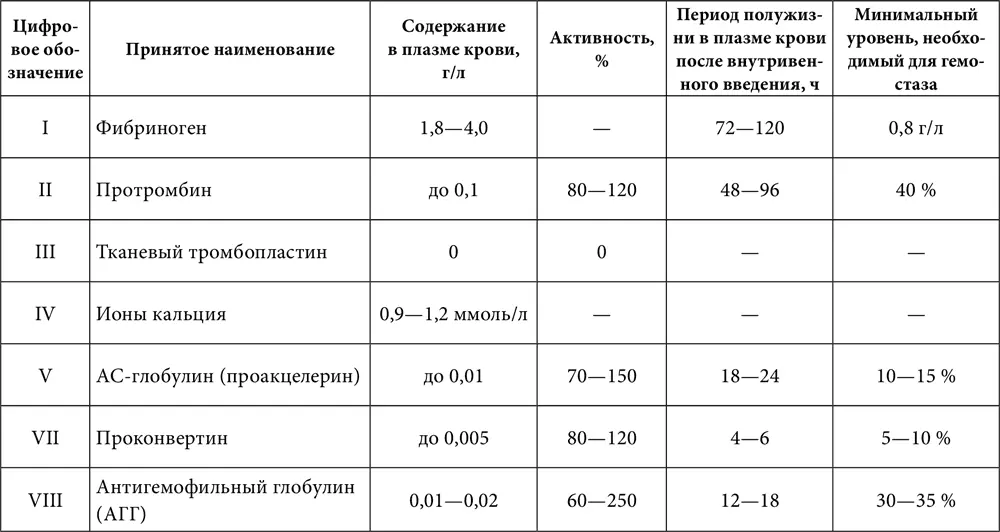
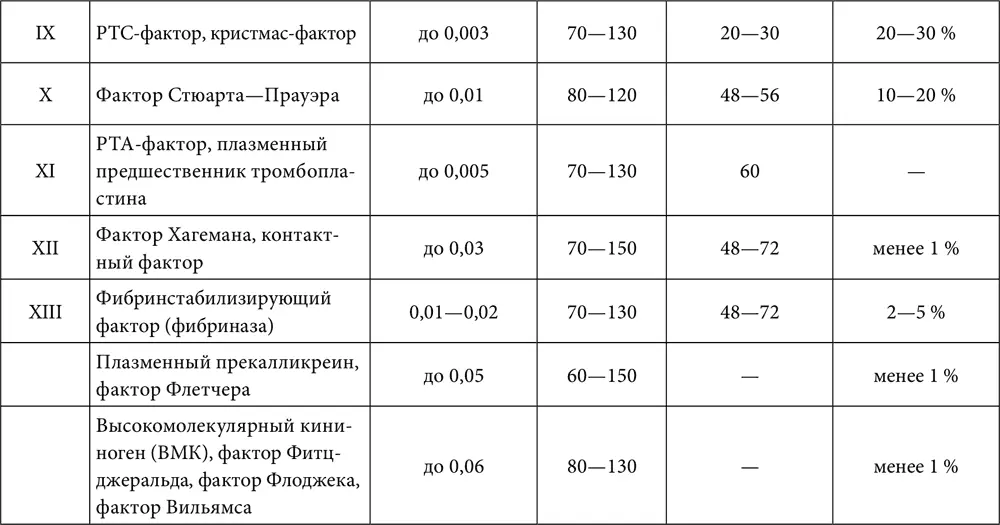
Внешний механизм запускается тканевым тромбопластином, который может попадать в плазму крови из поврежденных (травмы, операции) тканей, стенок сосудов (вырабатывается поврежденным эндотелием при участии активированных тромбоцитов), а также поступать в кровоток с тканевой жидкостью (эмболия околоплодными водами, перитонеально-венозное шунтирование, различные виды шока). Непосредственно в крови тканевый тромбопластин может продуцироваться активированными моноцитами. В большом количестве тканевый тромбопластин вырабатывается и клетками некоторых злокачественных опухолей (в том числе лейкозными).
Тканевый тромбопластин образует комплекс с ионами кальция и фактором VII, активируя последний, в результате образуется мощный ферментный активатор фактора X.
Внутренний механизм значительно более сложен и важен для расшифровки патогенеза и диагностики наиболее часто встречающихся в клинической практике геморрагических диатезов – гемофилии А и В , ангиогемофилии, или болезни Виллебранда (на их долю приходится большинство всех наследственных геморрагических коагулопатий).
При внутреннем механизме свертывание крови (плазмы) реализуется без участия тканевого тромбопластина. Пусковым фактором этого механизма является фактор XII (Хагемана), активация которого происходит вследствие контакта крови либо с чужеродной поверхностью (стеклом, металлом), либо с субэндотелием (коллагеном) и другими компонетами соединительной ткани, что наблюдается при повреждении стенок кровеносных сосудов (при механических травмах, васкулитах, атеросклерозе). Кроме того, активация фактора XII может осуществляться путем его ферментативного расщепления (калликреином, плазмином или другими протеазами).
Вместе с тем внешний и внутренний механизмы активации не изолированы друг от друга, взаимодействуют между собой. Многие факторы свертывания и фибринолиза синтезируются в печени. Из них факторы II, VII, X и IX, а также антикоагулянты – протеины С и S К -витаминозависимы: конечный этап их синтеза (карбоксилирование) нарушается при дефиците витамина К и под влиянием его антагонистов – кумаринов, фенилина. При этом нарушается образование в клетках печени К -витаминозависимой карбоксилазы, что лишает факторы свертывания способности к активации.
Противосвертывающая система
Физиологические антикоагулянтынеобходимы для поддержания крови в жидком состоянии и тормозят процессы образования тромбов. Могут быть подразделены на две основные группы:
1) первичные – самостоятельно синтезируемые и постоянно содержащиеся в крови;
2) вторичные – образующиеся при высвобождении активных веществ из клеток (протеолиз) при свертывании крови и фибринолизе.
Среди первичных антикоагулянтов наиболее важны следующие белки-ингибиторы.
Антитромбин III – универсальный ингибитор почти всех ферментных факторов свертывания. На его долю приходится более 75 % всей антикоагулянтной активности плазмы крови, причем этот же белок является основным плазменным кофактором гепарина. При наследственном или приобретенном (вторичном) снижении уровня антитромбина III возникает тяжелое тромбофилическое состояние, характеризующееся рецидивирующими тромбозами магистральных вен конечностей и внутренних органов, тромбоэмболиями легочной артерии, инфарктами органов. При уровне антитромбина III ниже 30 % больные часто погибают в молодом возрасте от тромбоэмболии, причем гепарин не оказывает на их кровь заметного антикоагулянтного действия. Скрытая наклонность к тромбозам возникает уже при снижении уровня антитромбина III ниже 70–75 %, но в этом случае тромбоэмболии развиваются на фоне дополнительных провоцирующих факторов (беременность и ее токсикозы, послеоперационный период, травмы и значительное физическое напряжение, прием контрацептивных гормональных препаратов и ингибиторов фибринолиза).
Вторичное снижение уровня антитромбина III в плазме крови закономерно развивается при ДВС-синдроме (диссеминированное внутрисосудистое свертывание – нарушенная свертываемость крови по причине массивного высвобождения из тканей тромбопластических веществ) и массивных тромбозах (вследствие интенсивного расходования на нейтрализацию факторов свертывания), в процессе лечения гепарином, который активирует и ускоряет метаболизм антитромбина III, в раннем послеоперационном периоде, при заболеваниях печени, лечении L -аспарагеназой и некоторых других ситуациях. Во всех этих случаях возникает опасность развития вторичных и рикошетных тромбозов.
В связи с этим динамический контроль над уровнем антитромбина III и гепаринорезистентностью плазмы приобретает большое клиническое значение как для оценки степени тромбогенной опасности, так и для своевременной коррекции дефицита этого антикоагулянта трансфузиями свежезамороженной плазмы крови, концентратами антитромбина III, удалением из крови белков острой фазы (плазмаферез).
Протеин С – синтезируемый гепатоцитами К -витаминозависимый профермент, активирующийся тромбином (а также трипсином и ядом гадюки Рассела), после чего он приобретает способность расщеплять и инактивировать основные неферментные ускорители процесса свертывания – факторы VIII и V.
Дефицит протеина С имеет значение в клинике. Описана наследственная его форма, при которой у больных с детского или юношеского возраста возникали рецидивирующие тромбозы. Глубокое вторичное угнетение протеина С (вплоть до почти полного исчезновения из крови) наблюдается при остром ДВС-синдроме (быстрый клиренс активированного тромбином белка из плазмы), респираторном дистресс-синдроме, тяжелых поражениях печени; менее значительное – в послеоперационном периоде.
Определяются протеин С и все взаимодействующие с ним белки иммунологически с помощью соответствующих специфических антисывороток.
Читать дальшеИнтервал:
Закладка: