Сергей Ястребов - От атомов к древу. Введение в современную науку о жизни
- Название:От атомов к древу. Введение в современную науку о жизни
- Автор:
- Жанр:
- Издательство:Альпина нон-фикшн
- Год:2018
- Город:Москва
- ISBN:978-5-9614-5286-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Сергей Ястребов - От атомов к древу. Введение в современную науку о жизни краткое содержание
Рекомендуется широкому кругу читателей, всерьез интересующихся современной биологией.
От атомов к древу. Введение в современную науку о жизни - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Для начала представим, что молекулу полипептида бросили в воду. Очевидно, что она не останется там вытянутой в прямую линию, а будет как-то сворачиваться. Это сворачивание будет зависеть от взаимодействия аминокислотных остатков как с молекулами воды, так и между собой. В целом пептидная цепь устроена довольно просто: ее «скелет» образуют пептидные группы, соединяющие между собой альфа-атомы углерода, а радикалы торчат в стороны. Все эти части огромной молекулы как-то размещаются в пространстве относительно друг друга, и в результате белок приобретает свою трехмерную форму — как обычно говорят, конформацию . Белок с нарушенной конформацией, как правило, совершенно бесполезен для организма. Поэтому соблюдение конформации — это очень важно.
Как же она складывается? Есть четыре типа взаимодействий между аминокислотами, определяющих объемную структуру белка, в который они входят.
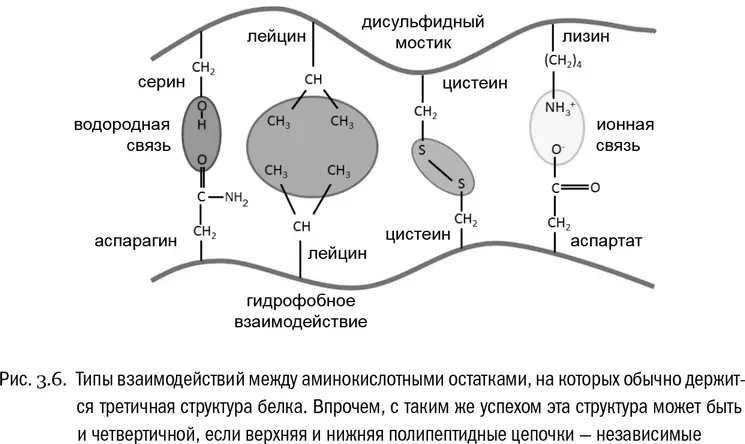
Во-первых, это водородные связи (см. главу 2). В белке их обычно много, они возникают и между пептидными группами, и между боковыми цепями аминокислот («боковая цепь» и «радикал» — в данном случае синонимы). Особенно это относится к тем аминокислотам, радикалы которых нейтральны и гидрофильны — вроде, например, серина или тирозина.
Во-вторых, это гидрофобное притяжение между углеводородными радикалами, принадлежащими таким аминокислотам, как валин, лейцин или фенилаланин. Вода выталкивает эти радикалы точно так же, как вытолкнула бы обычные молекулы углеводородов, и они отлично слипаются вместе, если оказываются при сворачивании белковой молекулы близко друг к другу. А тем самым они это сворачивание и закрепляют.
В-третьих, существует электростатическое притяжение между положительно и отрицательно заряженными боковыми цепями. Если, например, глутамат (радикал которого заряжен отрицательно) окажется при сворачивании белка рядом с лизином (радикал которого заряжен положительно), между ними тут же возникнет самая настоящая ионная связь.
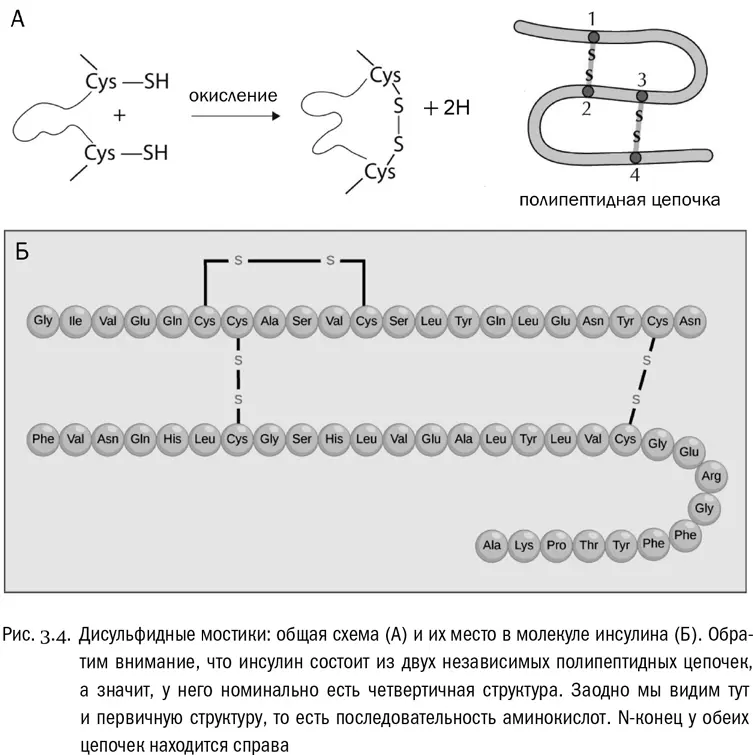
Есть и четвертый тип взаимодействий. Он зависит от единственной аминокислоты, радикалы которой могут образовать между собой аж ковалентные связи (не имеющие никакого отношения к пептидным). Эта аминокислота — цистеин. В радикале цистеина есть сульфгидрильная группа −SH, аналогичная спиртовой группе (−OH), но с атомом серы вместо атома кислорода. Целиком радикал цистеина имеет вид −CH 2−SH. Так вот, уже в готовом белке может произойти реакция, при которой у двух таких радикалов будет отобран водород (его унесут специальные молекулы-переносчики), а свободные валентности атомов серы замкнутся друг на друга и образуют между остатками цистеина связь −S−S−. Это называется дисульфидным мостиком (см. рис. 3.4А). Белок вполне может быть в нескольких местах «сшит» такими мостиками (см. рис. 3.4Б). Причем реакция их образования обратима: дисульфидные мостики могут возникать и рваться, и это бывает важно для регуляции некоторых физиологических процессов.
Связи и уровни
Для удобства принято выделять четыре уровня структуры белка. Они так и называются: первичная структура, вторичная, третичная и четвертичная.
Первичная структура — это просто последовательность аминокислот, соединенных пептидными связями (см. рис. 3.4Б). Она всегда линейна, ибо белки не ветвятся. Перечислять аминокислоты в белке принято от N-конца (свободная аминогруппа) к C-концу (свободная карбоксильная группа). Множество таких перечислений, то есть записей первичной структуры белков, есть в современных электронных базах данных, доступных в сети. Можно сказать, что первичная структура белка одномерна, в то время как все остальные уровни — трехмерны. К первичной структуре относятся только пептидные связи, а к остальным уровням — любые другие взаимодействия между аминокислотами, входящими в один и тот же белок.
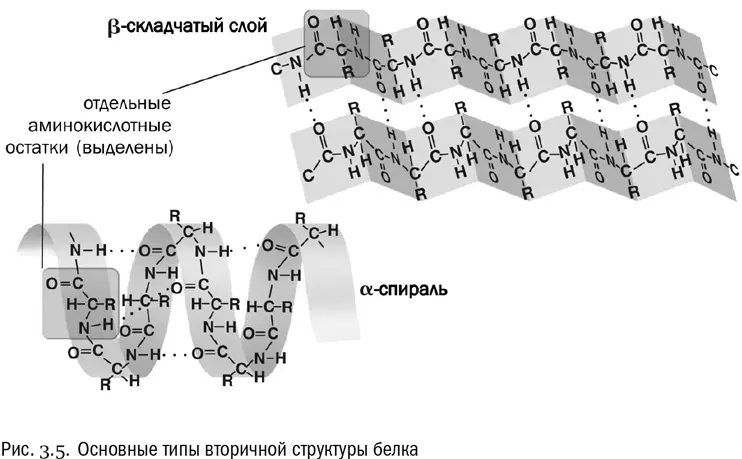
Вторичная структура — это система взаимодействий между аминокислотами в составе одной и той же полипептидной цепочки, расположенными близко (через считаные остатки друг от друга). Вторичная структура держится в основном на водородных связях (см. рис. 3.5). Причем в данном случае это связи между пептидными группами, а не боковыми цепями. А поскольку все пептидные группы одинаковы, то вторичная структура обладает высокой регулярностью, в ней часто повторяется один и тот же «узор».
Два самых распространенных типа вторичной структуры белка — альфа-спираль и бета-слой. В альфа-спирали водородные связи постоянно образуются между аминокислотными остатками с номерами n и (n+4), то есть каждая аминокислота образует водородную связь с аминокислотой, четвертой по счету от нее. В результате получается компактная спираль, внутри которой находятся пептидные группы, а радикалы торчат в стороны. Альфа-спираль очень устойчива, в том числе и потому, что внутри нее в образовании водородных связей принимают участие все пептидные группы без исключения. В бета-слое полипептидная цепочка несколько раз перегибается, и водородные связи образуются между ее противоположно направленными отрезками.
Третичная структура белка — это система взаимодействий между сколь угодно далекими (но принадлежащими к одной и той же полипептидной цепи) остатками аминокислот (см. рис. 3.6, 3.7А). Она определяет, какую форму будет иметь молекула белка целиком. Если вторичная структура — это ближний порядок, то третичная — дальний порядок. В образовании третичной структуры участвуют водородные связи между боковыми цепями, гидрофобные взаимодействия (очень частый случай) и ионные связи между заряженными боковыми цепями. И дисульфидные мостики тоже вносят в третичную структуру свой вклад.
Наконец, четвертичная структура возникает в том случае, если функциональный белок собирается из нескольких отдельных полипептидных цепей (см. рис. 3.7Б). Если белок состоит из одной полипептидной цепи, значит, четвертичной структуры у него нет. Взаимодействия, создающие четвертичную структуру, те же самые, что и в третичной структуре, только не внутри одной полипептидной цепи, а между разными цепями.
Типичный белок с четвертичной структурой — гемоглобин, переносящий кислород в нашей крови. Его молекула состоит из четырех полипептидных цепочек, которые синтезируются отдельно, но свою функцию выполняют только вместе. Объединяются они в основном за счет гидрофобных взаимодействий. Всего молекула нормального гемоглобина взрослого человека включает 574 аминокислоты.
Читать дальшеИнтервал:
Закладка:









