М. Канунго - Биохимия старения
- Название:Биохимия старения
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1982
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Канунго - Биохимия старения краткое содержание
Предназначена для биологов, биохимиков, геронтологов, врачей-гериатров.
Биохимия старения - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Имеется ряд примеров, подтверждающих корреляцию между дефицитом иммунокомпетенции и неоплазией. Частота рака примерно в 10–20 раз выше у людей, которые с детства имеют иммунодефицит. Хотя они живут недолго, у них наблюдают высокую заболеваемость раком [108]. Частота рака у людей, имеющих иммунодефицит во взрослом состоянии, также выше, чем у обычных людей [31, 108]. Больные, которым вводили антилимфоцитарную сыворотку (АЛС), имеют более высокую заболеваемость раком потому, что, как полагают, АЛС специфически подавляет функцию Т-клеток [109]. После иммунодепрессии частота спонтанных опухолей у животных и человека возрастает примерно в 350 раз. К тому же после иммунодепрессии у животных легче приживаются трансплантаты опухолей, а частота метастазов пересаженных опухолей выше [83, 108]. Смертность у людей, имеющих дефицит клеточного иммунитета, выше, чем у обычных людей.
Причина высокой частоты неоплазий при иммунодефиците неизвестна. Высказано предположение, что "иммунный надзор" необходим для элиминации злокачественных клеток, которые могут нести "не свои" антигены [13]. Считается, что злокачественное заболевание возникает из-за ослабления в пожилом возрасте Т-клеточного надзора, в результате чего появляются злокачественные клетки. Однако исследование Т-дефицитных мышей (мыши, родившиеся с дефектным тимусом) показало, что Т-клетки не существенны для надзора за некоторыми опухолевыми клетками [110, 111]. Другая возможность заключается в том, что при иммунодефиците онкогенные вирусы лучше размножаются, так как усиление активности Т-супрессоров при неопластических заболеваниях препятствует действию Т-киллеров, которые осуществляют надзор. Итак, взаимосвязь злокачественных заболеваний с иммунодефицитом не вызывает сомнений, но что из них является следствием, а что — причиной, пока неизвестно; механизм, посредством которого одно может влиять на другое, остается невыясненным.
Ослабление функции тимуса
Несколько авторов сообщили о том, что структурная и функциональная инволюция тимуса заканчивается в периоде, предшествующем завершению роста. Морфологические исследования Эндрью [4] и Сантисбибена [101] показали, что вес лимфоидной ткани тимуса начинает снижаться вскоре после достижения половой зрелости. Это происходит главным образом за счет атрофии коркового вещества (рис. 7.12); затем следует снижение уровня тимозина и числа Т-клеток [59]. Сколько-нибудь заметного уменьшения размеров лимфатических узлов и селезенки не наблюдали, но число центров размножения в этих органах снижается [16, 59, 89]. Количество циркулирующих Т-клеток прогрессивно падает после прохождения зрелого возраста, а их число у 60-70-летних людей составляет только ~70 % уровня, характерного для молодых [5, 22, 96]. У мышей функция Т-клеток при старении также снижается [38, 39, 68, 88, 112, 116]. Устойчивость к аллогенным опухолевым клеткам и пролиферативный ответ клеток селезенки на аллогенные клетки с возрастом быстро падают [88].
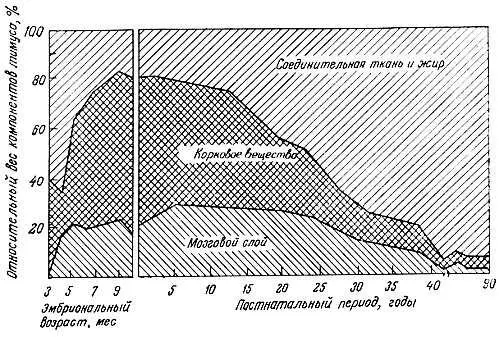
Рис. 7.12. Возрастные изменения компонентов тимуса человека [9]
Т-клетки проходят через тимус. Тимус подвергается обратному развитию вскоре после достижения половой зрелости, и этому сопутствует снижение определенных функций иммунитета. Предполагают, что ослабление иммунной функции вызвано уменьшением активности тимуса. Некоторые экспериментальные данные подтверждают это предположение. Снижение тимус-зависимых функций иммунитета возникает в период половой зрелости, когда тимус начинает подвергаться инволюции, и, следовательно, задолго до того, как проявляются иммунодефицитные заболевания пожилого возраста [74]. Иммунодефицит, амилоидоз и аутоиммунитет у неонатально тимэктомированных и генетически восприимчивых мышей можно предупредить или устранить пересадкой тимуса от молодых сингенных но не от старых мышей [26, 134]. Системная красная волчанка и рассеянный склероз у человека [40], а также патология мышей NZB, которая напоминает системную красную волчанку, вероятно, вызваны реакцией хозяина на некоторые вирусные антигены [78, 130]. Заболевание у мышей NZB развивается после снижения Т-ответа [110]. Начало этого заболевания можно замедлить введением тимоцитов молодых сингенных мышей [35]. У человека синтез антител к ядрам клеток, который является Т-зависимым, с возрастом усиливается [99].
Если считать, что частота рака в обычной популяции только 1:300, то у людей с иммунодефицитами, выявленными в детстве, она составляет 1:20, несмотря на то что продолжительность периода, в течение которого обычно развивается рак, у них меньше [31]. Как у животных, так и у человека иммунодепрессия под действием лекарств способствует увеличению заболеваемости раком [11]. Например, риск развития ретикулосаркомы у больных с иммунодепрессией примерно в 350 раз выше, чем у здоровых людей. Иммунодепрессия способствует приживлению пересаженных опухолей, а также метастазированию у человека и у животных [11, 135]. У людей со сниженным клеточным иммунитетом более высокая смертность, чем в общей популяции [69, 97]. Все эти наблюдения свидетельствуют о том, что с возрастом Т-клеточная функция нарушается, и это приводит к увеличению частоты рака, аутоиммунных и других заболеваний. Замедление или предупреждение снижения функции Т-клеток может отсрочить начало этих заболеваний или по крайней мере облегчить их протекание и тем самым замедлить процесс старения.
Некоторые данные, полученные in vitro, подтверждаются наблюдениями in vivo. Пролиферативный ответ Т-клеток на растительные митогены ФГА и конканавалин А у мышей и человека с возрастом значительно снижается [1, 29, 41, 56, 63, 88, 90, 97]. Вряд ли это обусловлено уменьшением связывания митогенов с рецепторами клеточных мембран [54], так как количество 125I-ФГА одинаково в молодых и старых клетках. Причиной могут быть молекулярные изменения, поскольку известно, что уровень циклического ГМФ (cGMP) после стимуляции митогеном в старых клетках увеличивается меньше, чем в молодых [45]. Правда, Эгервол и др. [2] сообщают, что при 37 °C ФГА одинаково стимулирует к делению и молодые, и старые клетки. Митотическая активность была изучена по включению 3Н-тимидина (рис. 7.13). Точность считывания ДНК-полимеразой в лимфоцитах двух доноров разного возраста тоже была одинаковой, хотя "старый" фермент оказался более термолабильным. Известно, кроме того, что ацетилирование гистонов в лимфоцитах, стимулированных ФГА, с возрастом снижается [85]. У мышей по мере старения замедляется образование цитотоксических лимфоцитов в смешанной культуре [47] и ослабевает функция Т-хелперов [42, 46, 91, 92].
Читать дальшеИнтервал:
Закладка:










