Джонджо МакФадден - Жизнь на грани
- Название:Жизнь на грани
- Автор:
- Жанр:
- Издательство:Питер
- Год:2016
- ISBN:978-5-496-02158-6
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Джонджо МакФадден - Жизнь на грани краткое содержание
Жизнь на грани - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Мы уменьшаемся и отправляемся в путешествие на молекулярном уровне, где объекты имеют размер несколько нанометров (несколько миллионных миллиметра). Представить себе такой крошечный масштаб невероятно трудно, поэтому для сравнения оцените размер буквы «о» на этой странице. Если бы мы с вами уменьшились до размера в несколько нанометров, то буква «о» приняла бы для нас такие же размеры, как территория Соединенных Штатов Америки при нашем нормальном росте. В таких условиях мы сможем рассмотреть, что внутреннее пространство клетки плотно заполнено молекулами воды, ионами металлов [36] Ионом называют атом или молекулу с электрическим зарядом, который является результатом утраты электронов (положительно заряженный ион) или их приобретения (отрицательно заряженный ион).
и многочисленными и разнообразными биомолекулами, среди которых встречаются аминокислоты причудливой формы. Этот шумный, заполненный до краев молекулами пруд непрерывно пребывает в волнении и движении. Молекулы вращаются, совершают колебания, сталкиваются друг с другом, словно бильярдные шары, о которых мы с вами говорили выше.
Среди всей этой толчеи беспорядочно движущихся молекул мы видим моллюскообразные ферменты, ползущие по волокнам коллагена. Движение молекул коллагеназы не похоже на то, как ведут себя остальные молекулы. Мы приближаемся к одной из молекул фермента как раз в тот момент, когда она движется вдоль коллагеновой белковой цепи. На первый взгляд молекула коллагеназы кажется тяжелой и бесформенной. Создается впечатление, что она хаотично собрана из разрозненных частей. Однако коллагеназа, как и все ферменты, имеет четкую структуру, в которой каждый атом занимает строго отведенное ему место. Кроме того, в отличие от беспорядочного пихания окружающих молекул, фермент исполняет изящный и слаженный молекулярный танец, обвиваясь вокруг коллагеновой нити, раскручивая ее спираль, чтобы сделать аккуратный надрез как раз в том месте, где пептидная связь скрепляет аминокислоты. Затем коллагеназа сворачивается и направляется дальше, к следующей пептидной связи в цепочке, чтобы разрушить ее. Это вовсе не уменьшенные копии механизмов, сделанных рукой человека, которые встроены в клетку и приводятся в движение хаотичными толчками беспорядочно разлетающихся в разные стороны частиц, напоминающих бильярдные шары. Это своеобразные нанороботы, сотворенные природой, которые исполняют внутри клетки тщательно поставленный танец. Каждое движение этого танца оттачивалось на протяжении миллионов лет в процессе естественного отбора, чтобы теперь управлять элементарными частицами живой материи.
Обратим все свое внимание на процесс разрушения пептидной связи. Для этого мы опускаемся к похожему на прищепку ответвлению молекулы фермента, которое, словно моллюск челюстью, фиксирует на месте субстраты реакции — белок коллаген и одну молекулу воды. Это место является активным центром фермента, его мастерской, в которой осуществляется ускорение распада пептидных связей, или, вспоминая нашу аналогию, разгибание и расширение горловины энергетических песочных часов. Хореографическая постановка, разворачивающаяся в молекулярном центре управления, отличается от той беспорядочной толкотни, которую устраивают другие молекулы вокруг фермента. Более того, этот танец играет несоизмеримо более важную роль в жизнедеятельности лягушки, чем движение любой другой молекулы.
Активный центр фермента изображен на рис. 3.4.
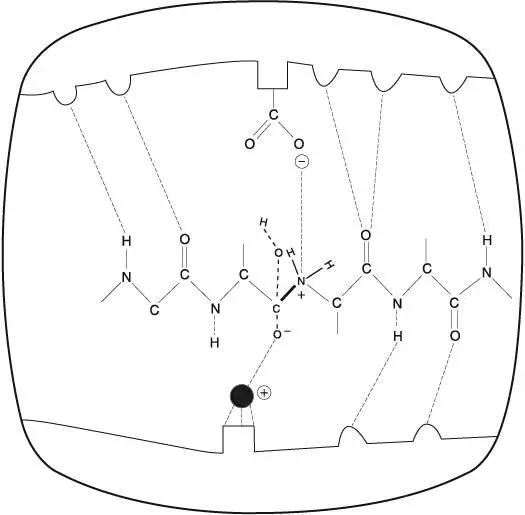
Рис. 3.4.Разрыв пептидной связи (обозначена жирной линией) коллагена в активном центре фермента. Переходное состояние субстрата обозначено пунктирными линиями. Шарик внизу, чуть левее от центра рисунка, — положительно заряженный ион цинка; карбоксильная группа COO вверху принадлежит молекуле глутаминовой кислоты (аминокислота, находящаяся в активном центре фермента). Обратите внимание, что параметры масштаба расстояний между молекулами на рисунке не выдержаны
Сравнив данное изображение с рис. 3.3, вы заметите, что фермент продлевает переходное состояние пептидной связи, которого она должна достичь для полного разрушения. Между субстратами образуются слабые химические связи, обозначенные на рисунке пунктирными линиями. Эти связи представляют собой отдельные электроны, которые субстраты делят с ферментами. Благодаря этим связям субстраты приобретают определенную конфигурацию, в которой молекуле фермента, вернее, ее молекулярным «челюстям», удобнее всего разорвать пептидную связь.
Приближаясь к месту пептидной связи, «челюсти» фермента совершают нечто более утонченное по сравнению с простым перекусыванием связи: они предоставляют средство, благодаря которому осуществляется ускорение реакции — катализ. Мы замечаем крупный атом с положительным зарядом, висящий прямо под мишенью — местом пептидной связи, которая уже развернута в удобное положение. Эта частица — положительно заряженный атом цинка. Если мы принимаем активный центр фермента за его челюсти, то атом цинка — один из резцов. Положительно заряженный атом забирает электрон у атома кислорода одного из субстратов, придавая устойчивости переходному состоянию и, следовательно, деформируя энергетический рельеф. Горловина песочных часов расширяется.
Оставшуюся работу выполняет другой «резец» фермента — его собственная аминокислота, известная как глутамат (глутаминовая кислота). Молекула глутамата также принимает необходимое положение, располагая свой отрицательно заряженный атом кислорода непосредственно над местом пептидной связи. Первоначальная роль этой молекулы заключается в том, чтобы оторвать положительно заряженный протон от связанной молекулы воды. Затем она подбрасывает этот протон атому азота, расположенному на одном из концов пептидной связи. Атом азота получает положительный заряд, притягивающий электрон, который участвует в пептидной связи. Как вы помните, электроны служат своего рода клеем пептидных связей. Изъятие электрона из пептидной связи сходно с тем, как если бы мы разъединили склеенные поверхности и соскоблили клей — поверхности бы уже не соединились [37] Tallant C., Marrero A. and Gomis-Ruth F. X. Matrix metalloproteinases: fold and function of their catalytic domains // Biochimica et Biophysica Acta (Molecular Cell Research), 2010. — Vol. 1803: 1. — P. 20–28.
. После перестановки нескольких электронов из молекулярных «челюстей» фермента наконец высвобождаются продукты реакции — разрушенные пептидные цепочки. Таким образом, реакция, которая без фермента протекала бы как минимум 68 миллионов лет, совершается за несколько наносекунд.
Интервал:
Закладка:









