Александр Марков - Эволюция. Классические идеи в свете новых открытий
- Название:Эволюция. Классические идеи в свете новых открытий
- Автор:
- Жанр:
- Издательство:АСТ: CORPUS
- Год:2014
- Город:Москва
- ISBN:978-5-17-083218-7
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Марков - Эволюция. Классические идеи в свете новых открытий краткое содержание
Книга Александра Маркова и Елены Наймарк рассказывает о новейших исследованиях молекулярных генетиков и находках палеонтологов, которые дают ответы на эти и многие другие вопросы о видоизменениях в природе. Тысячи открытий, совершенных со времен Дарвина, подтверждают догадки родоначальников теории эволюции; новые данные ничуть не разрушают основы эволюционной теории, а напротив, лишь укрепляют их.
Александр Марков, заведующий кафедрой биологической эволюции биофака МГУ, и Елена Наймарк, ведущий научный сотрудник Палеонтологического института им. А. А. Борисяка, — известные ученые и популяризаторы науки. Двухтомник «Эволюция человека» (2011), написанный ими в соавторстве, стал настольной книгой не только для студентов и ученых-биологов, но и для множества людей за пределами профессионального сообщества.
Эволюция. Классические идеи в свете новых открытий - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Повторы CRISPR-последовательностей в пределах каждого вида микробов почти одинаковы, но сильно различаются от вида к виду.
В 2007 году было показано, что бактерия Streptococcus thermophilus в ходе борьбы с вирусами-бактериофагами изменяет свой локус CRISPR, достраивая к концу старой последовательности одну или несколько единиц «повтор/спейсер». Добавленные спейсеры совпадали с участками вирусного генома. При этом бактерии приобретали устойчивость к данному вирусу. Если изменить последовательность нуклеотидов нового спейсера или вообще удалить его, приобретенная устойчивость к фагу теряется.
В последующие два года ученые доказали, что локусы CRISPR эволюционируют в ответ на вирусные атаки, так что состав и порядок расположения спейсеров — это своебразная хроника вирусных инфекций, перенесенных данной бактерией и ее предками. Итак, взаимодействие с вирусами приводит к появлению иммунитета, который сохраняется в ряде поколений.
В формировании иммунитета участвуют Cas-белки. Без них микроб не может вставлять в свой геном вирусную или плазмидную ДНК в качестве спейсеров. Если в клетку проникает чужеродная ДНК, то Cas-белки перво-наперво распознают ее. Потом они же вырезают участок чужой ДНК и встраивают в локус CRISPR новую рабочую единицу «повтор/спейсер». Обновленная бактериальная хромосома нормально реплицируется и передается по наследству потомкам.
При транскрипции CRISPR формируется цепочка РНК (CRISPR-РНК, или crРНК), которая затем нарезается на короткие кусочки, состоящие из двух половинок палиндромного повтора и заключенного между ними спейсера. Эту нарезку также осуществляют Cas-белки.
В результате получается внушительный набор коротких сгРНК с различными вирусными спейсерами. Среди них и тот, который был счастливо приобретен при недавнем инфицировании. Молекулы crРНК объединяются с некоторыми Cas-белками. Если в клетку снова попадет такой же вирус, то РНК, несущая соответствующий спейсер, узнает комплементарный участок вирусной ДНК, а Сas-белки обезвредят ее. Узнавание чужой ДНК при помощи комплементарной crРНК происходит эффективно и быстро.
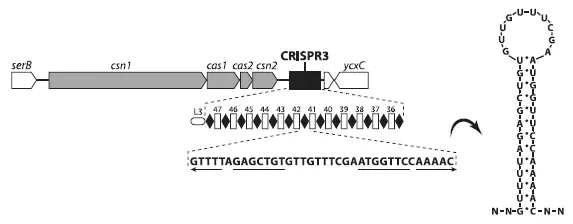
Схема одного из двух локусов Streptococcus thermophilus , содержащих CRISPR и ассоциированные гены cas . Серым цветом показаны cas -гены, черным — CRISPR-последовательности. Под черным прямоугольником вынесена подробная структура CRISPR. Черные ромбики — это палиндромные повторы, а белые маленькие прямоугольники — спейсеры, представляющие собой участки плазмидной или вирусной ДНК. Буквами внизу обозначена нуклеотидная последовательность палиндромного повтора. Справа — «шпилька», петлеобразная структура, в которую сворачивается РНК, считанная с палиндромного повтора. Из Horvath , Barrangou, 2010 .
При частых атаках определенного вируса соответствующая рабочая единица «повтор/спейсер» поддерживается в рабочем состоянии в ряде поколений (мутации, повреждающие ее, отсеиваются отбором). Если же паразит больше не нападает, то соответствующая единица «повтор/спейсер» со временем накопит мутации, перестанет работать или исчезнет. Так что CRISPR-иммунитет — это самонастраивающаяся система ( Horvath, Barrangou, 2010 ).
В любой иммунной системе важнейшая проблема состоит в том, чтобы предотвратить атаку защитных молекул на собственный организм. Иммунная система должна отличать свое от чужого, иначе это будет не иммунитет, а самоубийство. Американским ученым из Северо-Западного университета (Эванстон, США) удалось выяснить, как бактерии решают эту задачу. Оказалось, что в узнавании чужеродной ДНК участвуют не только спейсеры, но и ограничивающие спейсер фрагменты палиндромных повторов. Если комплементарным оказывается не только спейсер, но и окружающие его нуклеотиды, то это «родная» ДНК, и иммунной атаки не происходит. Если же спейсер комплементарен проверяемой последовательности, а фрагменты повторов — нет, то это чужой геном, и тогда белки Cas избавляются от паразитической ДНК ( Marraffini, Sontheimer, 2010 ).
Итак, система CRISPR позволяет микробам напрямую вносить полезные изменения в свой геном, не прибегая к помощи случайных мутаций и отбора. Своеобразный (и, по-видимому, совершенно уникальный) способ быстрого создания полезных наследственных признаков! Но сама эта замечательная система, конечно, развилась более традиционным способом. Ее происхождение пока не выяснено в деталях, однако прослеживается преемственность между ней и системой РНК-интерференции, о которой рассказано выше ( Deltcheva et al., 2011 ).
Бактериальные гены помогли нематодам стать паразитами
Число доказанных случаев горизонтального переноса генов от бактерий к животным пока невелико, но быстро растет. О двух из них мы рассказали в «Рождении сложности» (о переносе генов паразитической бактерии вольбахии в геном насекомого-хозяина и о заимствовании бделлоидными коловратками генов бактерий, грибов и растений). Кроме того, обнаружено заимствование генов тлями у своих бактериальных симбионтов ( Nikoh, Nakabachi, 2009 ), а также перенос генов водоросли в геном удивительного морского моллюска Elysia chlorotica . Этот моллюск, похожий на ползающий зеленый листок, сохраняет хлоропласты съеденных водорослей живыми в своих тканях и таким образом приобретает способность к фотосинтезу ( Rumpho et al., 2008 ). Заимствованные у водорослей ядерные гены помогают моллюску обслуживать ворованные хлоропласты (имеющие собственный маленький геном). Вот уж поистине радикальное эволюционное новшество: фотосинтезирующее животное!
Во всех этих случаях речь идет либо о переносе генов от симбионта к хозяину (что помогает хозяину обеспечивать симбионта всем необходимым), либо о заимствованиях, польза которых не вполне очевидна. В принципе эти случаи можно было бы рассматривать как курьезы, не играющие важной роли в эволюции животных. Другое дело, если бы удалось показать роль ГПГ в становлении какой-нибудь большой и экологически значимой группы животных.
Именно это удалось сделать в последние годы на примере фитопатогенных нематод (круглых червей) ( Danchin et al., 2010 ). Нематоды, паразитирующие на растениях, — опаснейшие вредители: причиняемый ими ущерб оценивается в 157 млрд долларов в год. Уникальная особенность фитопатогенных нематод — наличие впечатляющего арсенала ферментов для разрушения компонентов стенки растительных клеток: целлюлозы, гемицеллюлоз и пектинов. Эти ферменты необходимы паразитам для проникновения в ткани растения и перемещения в них. У других животных, за редчайшими исключениями, таких ферментов нет. Зато они есть у многих бактерий и грибов. Поэтому напрашивается предположение, что нематоды позаимствовали соответствующие гены у бактерий или грибов путем горизонтального переноса.
Читать дальшеИнтервал:
Закладка:









