Александр Марков - Рождение сложности. Эволюционная биология сегодня: неожиданные открытия и новые вопросы
- Название:Рождение сложности. Эволюционная биология сегодня: неожиданные открытия и новые вопросы
- Автор:
- Жанр:
- Издательство:Астрель, Corpus
- Год:2010
- Город:Москва
- ISBN:978-5-271-24663-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Марков - Рождение сложности. Эволюционная биология сегодня: неожиданные открытия и новые вопросы краткое содержание
Рождение сложности. Эволюционная биология сегодня: неожиданные открытия и новые вопросы - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
—————
Взять, к примеру, тот же альтернативный сплайсинг. Каким образом клетка «решает», какой из вариантов сплайсинга нужно выбрать в данной ситуации (и, следовательно, какой из вариантов белка синтезировать)? Об этом пока известно очень мало. Удалось выяснить, что такая регуляция требует участия особых белков — регуляторов сплайсинга. Не было оснований думать, что сплайсинг регулируется чем-то еще, кроме белков. И вдруг ученые из Йельского университета (США) публикуют статью [108] Ming T. Cheah, Andreas Wachter, Narasimhan Sudarsan, Ronald R. Breaker. Control of alternative RNA splicing and gene expression by eukaryotic riboswitches // Nature. 2007. V. 447. P. 497–500.
, в которой описан совершенно иной способ регуляции, где белки не участвуют вообще. Ключевую роль в нем играет сама молекула РНК, подвергающаяся сплайсингу.
Способность молекулы РНК самостоятельно определять свою судьбу и выбирать способ, каким она будет перекроена, определяется наличием в одном из ее некодирующих участков (интронов) специфической последовательности нуклеотидов, которая сама собой сворачивается в особую трехмерную структуру — РНК-переключатель. О том, что это такое, мы уже рассказывали в главе «Происхождение жизни».
Исследование проводилось на грибе Neurospora crassa , известном широкой публике как розовая хлебная плесень. По иронии судьбы, на этом же объекте в 40-е годы прошлого века были получены сенсационные результаты, позволившие сформулировать принцип «один ген — один белок». Сейчас на нейроспоре изучают альтернативный сплайсинг — явление, опровергающее (или, лучше сказать, уточняющее и расширяющее) этот замечательный принцип.
У нейроспоры, как и у ряда других эукариот, в генах, участвующих в биосинтезе тиамина (витамина B 1), были обнаружены участки, сходные с известными бактериальными РНК-переключателями, которые реагируют на производное тиамина — тиамин-пирофосфат. Большинство известных РНК-переключателей действуют по принципу отрицательной обратной связи. Они реагируют на вещество, синтезируемое белковым продуктом данного гена, и при достаточно высокой концентрации этого вещества отключают ген.
Примерно то же самое наблюдалось и в данном случае. Повышение концентрации тиамин-пирофосфата в клетках гриба приводит к снижению производства белков, ответственных за синтез тиамина. Было показано, что если удалить из соответствующих генов участки, похожие на бактериальные РНК- переключатели, то производство тиамин-синтезирующих белков перестает зависеть от концентрации тиамин-пирофосфата.
Таким образом, стало ясно, что участки грибных генов, похожие на РНК-переключатели, действительно являются таковыми. Оставалось лишь выяснить механизм их действия, то есть понять, как они блокируют работу «своих» генов. У бактерий РНК-переключатели делают это либо на этапе транскрипции (первичного «прочтения» гена), либо на этапе трансляции — синтеза белка на матрице мРНК.
У эукариот, как выяснилось, дело обстоит иначе — работа гена блокируется на этапе сплайсинга. Бактериям это недоступно, поскольку у бактерий сплайсинга нет (почти нет, если быть точным). Тиаминовый РНК-переключатель в генах Neurospora crassa располагается в первом интроне, недалеко от начала гена. Если в клетке мало тиамин-пирофосфата, РНК- переключатель «приклеивается» одной из своих петель к строго определенному месту на молекуле мРНК. Это место является одним из потенциальных мест сплайсинга, то есть именно здесь в ходе сплайсинга молекула мРНК может быть разрезана. Однако приклеившийся РНК-переключатель не позволяет этого сделать, и молекула разрезается в другом подходящем месте по соседству. В результате формируется «правильная» зрелая мРНК, на основе которой синтезируется полноценный белок.
Если же в клетке много тиамин-пирофосфата, это вещество присоединяется к РНК-переключателю и изменяет его форму. Переключатель «отклеивается» от места сплайсинга и перестает его защищать. Тогда молекула РНК режется именно в этом месте, которое раньше прикрывалось РНК-переключателем. Это в конечном счете приводит к формированию «бракованной» зрелой мРНК, на базе которой полноценный белок синтезировать невозможно.
Таким образом, РНК-переключатель в зависимости от концентрации тиамин-пирофосфата направляет сплайсинг по одному из двух альтернативных путей.
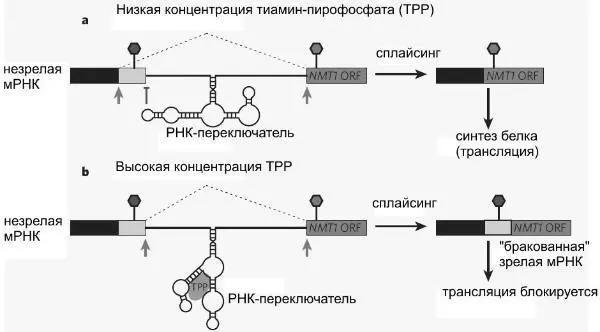
На этом рисунке показано, как РНК-переключатель регулирует альтернативный сплайсинг у розовой хлебной плесени (на примере гена NMT1). Участок мРНК, вырезаемый при сплайсинге, отмечен пунктирными линиями и серыми стрелками. При низкой концентрации тиамин-пирофосфата РНК-переключатель «защищает» потенциальный сайт (место) сплайсинга, отмеченный значком в виде буквы «Т». В результате при сплайсинге вместо этого сайта используется другой, расположенный по соседству (серая стрелка). Участок мРНК, отмеченный белым цветом, не попадает в зрелую мРНК. При высокой концентрации ТРР это вещество связывается с РНК-переключателем и меняет его конфигурацию. В результате молекула РНК режется в том месте, которое раньше было прикрыто РНК-переключателем, белый участок попадает в зрелую РНК и «портит» ее.
Судя по некоторым косвенным признакам, регуляция сплайсинга при помощи РНК-переключателей может быть довольно широко распространена у эукариот. Чтобы проверить это предположение, необходима разработка эффективных методов поиска РНК-переключателей в эукариотических геномах — эти методы пока еще далеки от совершенства.
Еще одна неожиданная функция РНК обнаружилась недавно в ходе изучения механизмов репарации — починки повреждений в ДНК. Оказалось, что молекулы РНК могут играть роль матриц, информация с которых переписывается в поврежденную молекулу ДНК взамен утерянной [109] Storici F., Bebenek K., Kunkel T. A., Gordenin D. A., Resnick M. A. RNA-templated DNA repair // Nature. 2007. V. 447. P. 338–341.
. Процесс основан на обратной транскрипции (как мы помним из предыдущей главы, так называют переписывание информации из РНК в ДНК, то есть синтез ДНК на РНК-матрице). Изобретение обратной транскрипции, между прочим, должно было стать важным переломным моментом в развитии РНК-мира, поскольку позволило РНК-организмам перейти к хранению наследственной информации в более надежной и стабильной форме молекул ДНК. В предыдущих главах мы упоминали несколько случаев использования обратной транскрипции современными организмами: это перемещение и размножение ретротранспозонов и ретровирусов, образование ретропсевдогенов, восстановление укорачивающихся при каждом клеточном делении кончиков хромосом — теломер. И вот еще один пункт добавился к этому списку — репарация ДНК.
Интервал:
Закладка:







