Вильгельм Штрубе - Пути развития химии. Том 2. От начала промышленной революции до первой четверти XX века
- Название:Пути развития химии. Том 2. От начала промышленной революции до первой четверти XX века
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1984
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Вильгельм Штрубе - Пути развития химии. Том 2. От начала промышленной революции до первой четверти XX века краткое содержание
Пути развития химии. Том 2. От начала промышленной революции до первой четверти XX века - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
В начале XX в. представления о строении электронных оболочек основывались на результатах исследования свойств света, излучаемого атомом при его возбуждении (электрическом или за счет повышения температуры). Излучаемый атомом свет состоит из узких линий определенной частоты, совокупность которых составляет линейчатый спектр атома.
После создания Бором модели атома понадобилось еще 12 лет, чтобы объяснить электронное строение атома (1925 г.). Получить представление о свойствах электронов было совершенно необходимо для понимания характера связи атомов и строения молекулы в целом.
После открытия электронов немецкий физико-химик Рихард Абегг в 1904 г. предположил, что, поскольку инертные газы не образуют химических соединений, то они должны иметь устойчивую электронную конфигурацию. Ученый утверждал, что химическая реакция представляет собой взаимодействие между электронами, а ядра атомов при этом остаются без изменения. Равным образом электронное строение должно определять валентность элементов в зависимости от того, сколько электронов может отдать или принять атом. Таким образом, речь шла об электронных оболочках, которые должны содержать определенное количество электронов.
Однако для точного установления электронных конфигураций не хватало данных о числе электронов в атоме и представлений о строении атома. Положение изменилось после того, как Г. Мозли определил порядковые номера элементов, а Н. Бор создал модель строения атома.
Порядковый номер элемента соответствовал общему числу электронов, которые Бор располагал на определенных орбитах, обозначив их буквами К, L, M, N, О, Р (последовательно от первой внутренней орбиты к последней внешней). Сообразно с этим на каждой орбите может находиться определенное число электронов. Наиболее стабильными при этом являются конфигурации с 2, 8, 18 и 32 электронами на орбите (соответствующие конфигурациям инертных газов).
Например такой атом, как гелий, имеет 2 протона и 2 электрона; поскольку при этом К-орбита насыщена, у гелия не наблюдается тенденции к приобретению или отдаче электронов. У атома натрия положение иное. Он содержит 11 электронов, располагающихся на К-, L- и М-орбитах: соответственно 2, 8, 1. Электронная конфигурация М-оболочки очень "нестабильна", так что натрий имеет склонность к отдаче одного электрона взаимодействующему с ним веществу и поэтому является сильно реакционноспособным элементом. В атоме хлора имеется 17 электронов, расположенных на трех орбитах: соответственно 2, 8, 7. На М-орбите не хватает одного электрона до устойчивой 8-электронной конфигурации, поэтому хлор легко образует соединение с натрием.
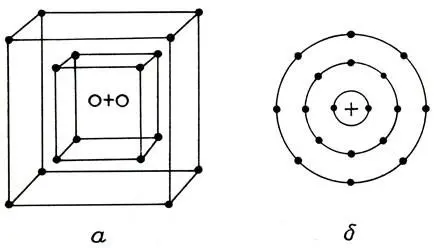
Модель атома аргона (1916 г.): а — по Косселю, б — по Бору
Такими электронными конфигурациями объяснялся и ионный тип химической связи. Атом натрия отдал электрон и приобрел положительный заряд, так как на 11 протонов в нем теперь приходилось 10 электронов. Так атом натрия становился ионом натрия. Аналогично атом хлора превращался в ион, поскольку после приобретения им одного электрона он становился отрицательно заряженным.
Противоположные заряды Na +и Сl -вызывают взаимное притяжение между обоими ионами и тем самым обусловливают стабильность образовавшегося соединения NaCl.
Изложенный выше способ образования связи между двумя различными элементами является результатом стремления атомов приобрести стабильную конфигурацию, аналогичную "конфигурации инертных газов" при объединении электронов атомов разных элементов. В приведенном выше примере атом натрия, превращаясь в ион Na +, приобретает электронную конфигурацию неона, а атом хлора, став ионом Cl -,- электронную конфигурацию аргона.
Электронная связь, изотопы, ядерные реакции
Оставался еще не выясненным вопрос, как осуществляется связь, например, в двухатомных молекулах одинаковых элементов. Ответ на это независимо друг от друга дали Вальтер Коссель в 1915г., а спустя год Гилберт Н.Льюис и Ирвинг Ленгмюр. Исходя из представлений Бора и Мозли о распределении электронов вокруг ядра атома, Коссель, Льюис, Ленгмюр объясняли связь между атомами в таких молекулах тем, что электроны атомов участвуют в образовании одной или более электронных пар. Таким образом, в молекуле становится возможным образование стабильной электронной конфигурации инертного газа. Например, при образовании молекулы хлора Сl 2происходит связывание электронов УИ-орбитали с образованием одной общей электронной пары двух атомов
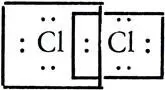
Объяснение физической природы химической связи на основе образования общих электронных пар ("атомная", гомеополярная ковалентная связь) имело особенное значение для органической химии при трактовке образования связей между двумя или несколькими атомами углерода или между атомами углерода и водорода. Впоследствии (после 1920 г.) Нэвил В. Сиджвик распространил представление о ковалентной связи и на неорганические соединения.

Ирвинг Ленгмюр (1881-1957)
После этого химические реакции стали интерпретироваться как результат смещения электронов, протоны при этом не играли никакой роли. В отличие от всех элементов только атом водорода, превращаясь в ион, может полностью освободиться от электронов (поскольку электрон у него единственный).
В 1913 г. английский радиохимик Фредерик Содди решил еще одну проблему. Исследование продуктов распада радиоактивных элементов приводило к противоречию с периодической системой. Например, свинец, образующийся при распаде урана, имел атомную массу, отличающуюся от массы обычного свинца. Ф. Содди предложил в 1913 г. название "изотоп" для любого элемента, который отличается от известного ранее элемента атомной массой, но занимает то же место в периодической системе [118]. Причина такого отклонения была обнаружена только в 1932 г. благодаря открытию нейтронов английским физиком Джеймсом Чэдвиком. Изотопами стали называть элементы, обладающие одинаковыми химическими свойствами и одним и тем же порядковым номером, но отличающиеся атомными массами. Порядковый номер определяется зарядом ядра атома (числом протонов), а атомная масса — числом протонов и нейтронов в атомном ядре. Благодаря использованию масс-спектрометрии после 1920 г. было обнаружено также, что многие элементы, образующиеся не в результате радиоактивного распада, являются смесью изотопов.
Читать дальшеИнтервал:
Закладка:


![Жорж Вигарелло - История тела Том 2 [От Великой французской революции до Первой мировой войны]](/books/1081096/zhorzh-vigarello-istoriya-tela-tom-2-ot-velikoj-fran.webp)







