Мартин Гарднер - Этот правый, левый мир
- Название:Этот правый, левый мир
- Автор:
- Жанр:
- Издательство:Мир
- Год:1967
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Мартин Гарднер - Этот правый, левый мир краткое содержание
Этот правый, левый мир - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
На этом лестница структурного строения материи кончается. Можно, конечно, говорить о еще более крупных единицах, из которых складываются минералы и горные породы, но никакого нового математического порядка в этом случае уже не наблюдается. Минерал это просто элемент или соединение, встречающееся в природе в твердом виде и не являющееся продуктом какого-либо жизненного процесса. Но если строение минерала и обнаруживает геометрически правильную структуру, то это кристаллическая структура, образованная упорядоченным расположением молекул. Горные породы это просто смесь различных минералов. Конечно, и горные породы могут залегать правильными слоями (вспомним осадочные породы), но упорядоченность здесь очень слабая, и вопросов о симметрии в той форме, которую мы здесь рассматривали, не возникает.
После краткого обзора строения вещества на разных уровнях мы можем вернуться к нашим исследованиям зеркальной симметрии. Начнем с верхней ступени нашей лестницы, со строения кристаллов, а в последующих главах спустимся на субатомный уровень — в джунгли мира элементарных частиц.
Только твердые тела имеют кристаллическую структуру. Молекулы газа так далеко отстоят друг от друга, что двигаются беспорядочно; в их расположении невозможно обнаружить никакой системы. Молекулы жидкости располагаются теснее, но все же места для движения достаточно, и у них тоже нет определенного порядка размещения. У твердых тел молекулы плотно упакованы и образуют прочные, устойчивые структуры. (В действительности атомы в твердом теле продолжают колебаться, но электромагнитные силы держат их так цепко, что они колеблются только около неподвижных точек. В нашем рассмотрении мы можем считать, что атомы неподвижны). Итак, в твердых телах молекулы расположены упорядоченным образом, а это и является основой кристаллического строения твердых тел.
Возьмем воду. И в газовом состоянии (пар), и в жидком ее молекулы движутся хаотически, но, когда вода замерзает и превращается в лед, расположение молекул упорядочивается. Красивые снежные кристаллы с гексагональной симметрией, напоминающие узоры в калейдоскопе, формой своей обязаны кристаллической структуре молекул льда, из которых они состоят. И обычный лед в виде кубиков из морозилок холодильников, и лед гигантских айсбергов Антарктики имеют одинаковую кристаллическую структуру, в основе которой лежит упорядоченный характер расположения молекул.
Почти все твердые тела кристаллические. Одним из замечательных исключений является стекло. Оно образуется при охлаждении некоторых жидкостей, причем столь быстром, что молекулы в замерзающем веществе не успевают «выстроиться» в определенном порядке. В своей прекрасной книге «Рост кристаллов» Алэп Холден и Филлис Сингер пишут: «Как бы ни называли стекло, твердым телом или нет, но это не кристалл. Граненая ваза для пунша — кристалл с точки зрения продавца, но не с точки зрения физика. „Прорицатели будущего“, которые раньше пытались увидеть это будущее, глядя в шар, выточенный из кристалла кварца, теперь чаще смотрят в стеклянный шар — он дешевле. Интересно бы узнать, видят ли они будущее сквозь хаотичную структуру стекла так же, как сквозь упорядоченный кристалл?»
Некристаллические твердые тела часто называют аморфными ; некоторые химики называют их «твердыми жидкостями», поскольку, как и жидкости, они не обладают кристаллической структурой. Примеры таких веществ всем известны — древесный уголь, различные смолы, пластмассы. Эти вещества, как и жидкости, имеют склонность к текучести, но скорость текучести может быть исключительно низкой. Даже само стекло может потечь и изменить свою форму, если дать ему полежать несколько сот лет.
Геометрически упорядоченная основа каждого кристаллического вещества называется кристаллической решеткой. Иногда она образуется атомами, иногда — молекулами. Двуокись углерода, например, встречается в природе в газообразном виде; это углекислый газ, входящий в состав атмосферы. Если достаточно сильно снизить его температуру, он замерзает, превращаясь в вещество, известное под названием «сухой лед». (Он «сухой» потому, что никогда не тает, как обычный лед, превращаясь в жидкость, а сразу становится газом.) В сухом льду молекулы двуокиси углерода образуют кубическую решетку, изображенную на рис. 22. Кубическая решетка, похожая по своему строению на стальные каркасы небоскребов, простейшая из всех возможных типов решеток. Из-за молекул, находящихся в центре каждой грани куба, такую решетку называют «гранецентрированной».
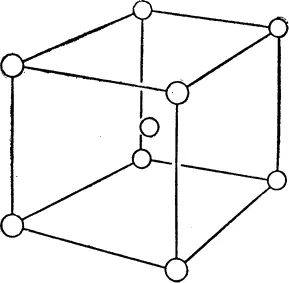
Другая разновидность кубической решетки, показанная на рис. 23 «объемноцентрированная» (обратите внимание на «атом» в центре куба). Таков кристалл металлического натрия. Решетка в данном случае образуется из атомов натрия.
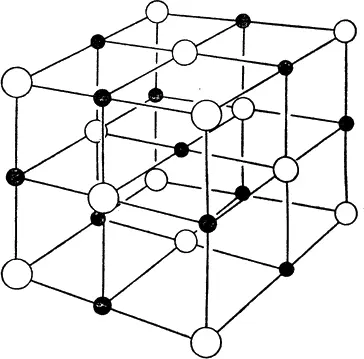
Хлорид натрия, или обычная поваренная соль, также имеет кубическую решетку (рис. 24), но атомы, образующие ее, ионизованы. У натрия на внешней оболочке только один электрон. У хлора на внешней оболочке семь электронов, но там можно разместить и восемь. На этой оболочке есть, так сказать, пустое место, куда можно поместить еще один электрон. Когда два атома встречаются, одинокий электрон натрия заполняет пустое место в оболочке хлора, образуя прочную, устойчивую молекулу поваренной соли. Поскольку каждый атом в такой решетке или лишен одного своего электрона, или имеет один лишний, то и несет соответственно положительный или отрицательный электрический заряд. Как упоминалось выше, такие атомы называются ионами. Из них и состоит кристаллическая решетка.
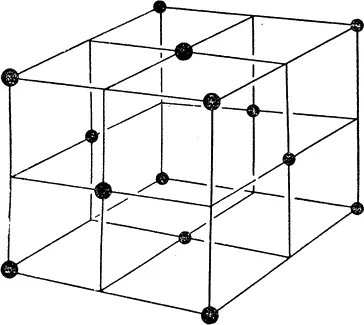
Строение кристаллической решетки оказывает сильное влияние на видимую форму кристаллических тел. Поваренная соль, например, легко раскалывается вдоль плоскостей решетки. Если вы внимательно посмотрите на кристаллы поваренной соли через увеличительное стекло (или, еще лучше, через микроскоп), то заметите, что крупинки соли имеют в действительности форму крошечных кубиков. Вы, конечно, увидите не элементарную кристаллическую решетку, изображенную на рисунке, — для этого не хватит увеличения лучших микроскопов — а всего лишь маленькие соляные кристаллики, которые принимают кубическую форму потому, что такова форма решетки поваренной соли.
Но не следует думать, что раз структуру решетки нельзя разглядеть в микроскоп, то она не более чем теоретическое построение, и увидеть ее в натуре никак нельзя. Когда-то это было так, но сейчас изобретено много способов «видеть» вещи, слишком маленькие для созерцания невооруженным глазом. Еще в 1912 году немецкий физик Макс фон Лауэ разработал метод наблюдения кристаллической структуры с помощью рентгеновских лучей. В последнее время стали доступны для наблюдения более мелкие детали, для чего через кристалл пропускают электроны, нейтроны и даже ионы. На обложке июньского номера «Сайентифик Америкен» за 1957 год помещена поразительная цветная фотография, показывающая расположение отдельных атомов в кристаллической решетке вольфрама. Фотография была получена с помощью нового прибора, называемого «ионным микроскопом», который дает изображение решетки, увеличенное в два миллиона раз! Так что, как видите, кристаллическая решетка — не выдумка математиков. Теперь она доступна довольно простым способам наблюдения.
Читать дальшеИнтервал:
Закладка:









