Тамара Рудакова - Основы физиологии сердца
- Название:Основы физиологии сердца
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2015
- ISBN:978-5-299-00608-7
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Тамара Рудакова - Основы физиологии сердца краткое содержание
Особое внимание уделено физиологическому обоснованию наиболее распространенных инструментальных методов исследования электрической активности, биомеханики, насосной и эндокринной функций сердца (электро-, фоно- и эхокардиография, электромагнитная и ультразвуковая флоуметрия), а также вопросам интерпретации данных клинической функциональной диагностики и фундаментальных экспериментальных исследований.
Пособие предназначено для студентов биологических и медицинских вузов, аспирантов, клинических ординаторов, широкого круга биологов, исследователей, преподавателей и практикующих врачей.
Основы физиологии сердца - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Миофибриллы, состоящие из белковых нитей – миофиламентов, – расположены в саркомере параллельно друг другу с высокой упорядоченностью и окружены мембранами цистерн саркоплазматического ретикулума, а также митохондриями. Различают два типа миофиламентов: толстые, образованные белком миозином, и тонкие, образованные другим белком – актином (рис. 2-1).
Молекула миозина состоит из длинной хвостовой части, суженной шейки и утолщенной головки. Каждая толстая нить содержит более 100 молекул миозина, собранных в пучок, в средней части которого находятся хвостовые частицы молекул, а на обоих концах – выступающие над поверхностью нити головки. Каждая тонкая нить состоит из двух линейных молекул актина, спирально скрученных друг с другом. В желобках между нитями актина уложены линейные молекулы белка тропомиозина (по две пары молекул на один шаг спирали актиновой нити). Вблизи соединений между двумя последовательными молекулами тропомиозина к актину прикрепляются глобулярные молекулы еще одного белка – тропонина, состоящего из трех субъединиц: I, T и С. Он принимает участие в процессах сопряжения возбуждения и сокращения рабочего миокарда.
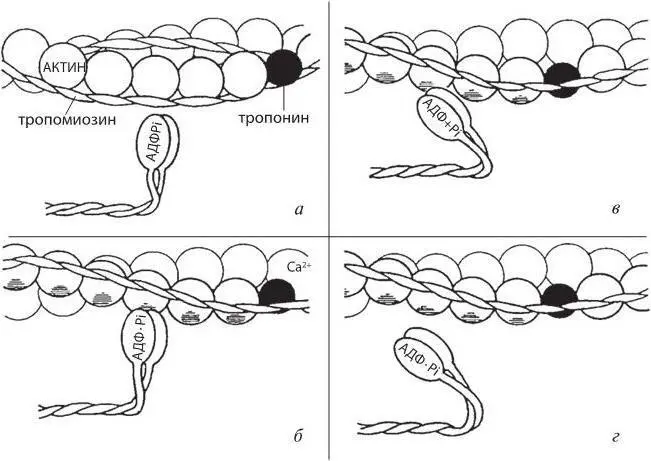
Рис. 2-1. Работа актомиозинового комплекса:
а – тонкий филамент состоит из трех протеинов. Его основу составляет актин. В состоянии расслабления миозинчувствительный сайт молекулы актина заблокирован тропомиозином. Когда кальций присоединяется к тропонину, последний претерпевает конформационную перестройку, в результате которой становится возможным взаимодействие актина и миозина; б – присоединение головки миозина к актину; в – скольжение тонких и толстых филаментов относительно друг друга. В результате гидролиза молекулы АТФ образуются АДФ и неорганический фосфат Pi; г – присоединение новой молекулы АТФ к головке миозина
2. Проводящие (атипичные, специализированные) кардиомиоциты имеют слабо развитый сократительный аппарат и формируют проводящую систему сердца. Среди этого вида кардиомиоцитов различают Р-клетки и клетки Пуркинье:
а) округлые Р-клетки (англ. рale – бледный) со светлой цитоплазмой, почти лишенной сократительных элементов, обладают способностью периодически генерировать электрические импульсы, обеспечивая (в норме) автоматию сердечной мышцы;
б) клетки Пуркинье имеют протяженную форму с большим диаметром и образуют волокна, осуществляя быстрое, незатухающее, своевременное и синхронное проведение возбуждения к сократительным кардиомиоцитам. Автоматия у клеток Пуркинье есть, но выражена в меньшей степени, чем у Р-клеток.
3. Переходные кардиомиоциты, или Т-клетки (англ. transitional – переходный), располагаются между проводящими и сократительными кардиомиоцитами и имеют промежуточные цитологические характеристики. Эти клетки обеспечивают взаимодействие остальных типов кардиомиоцитов.
4. Секреторные кардиомиоциты располагаются преимущественно в предсердиях и выполняют эндокринную функцию. В частности, эти клетки секретируют во внутреннюю среду предсердный натрийуретический пептид – гормон, принимающий участие в регуляции водно-электролитного баланса и артериального давления.
Морфологически сердечная мышечная ткань, в отличие от скелетной, не имеет симпластического строения, однако отдельные кардиомиоциты и структурно, и функционально тесно связаны друг с другом посредством вставочных дисков, особенно хорошо выраженных между сократительными кардиомиоцитами. Механическую связь обеспечивают находящиеся в области вставочного диска десмосомы и интердигитации, а функциональное взаимодействие – щелевые контакты (англ. gap junctions ), или нексусы. В зоне щелевых контактов, которая занимает около 10–20 % площади вставочного диска, мембраны соседних клеток находятся на очень малом (около 2–3 нм) расстоянии друг от друга и пронизаны каналами, которые представляют собой сложные белковые комплексы (коннексоны) и проницаемы для ионов. Такое строение межклеточных контактов обеспечивает их низкое электрическое сопротивление и свободную передачу электрического сигнала от одной клетки к другой (по типу электрического синапса). Вставочные диски, расположенные на торцах клеток, соединяют кардиомиоциты «конец в конец», что приводит к образованию мышечных волокон, которые также связаны друг с другом посредством вставочных дисков.
Таким образом, кардиомиоциты объединены в непрерывную электрическую сеть – функциональный синцитий, что отличает миокард от скелетных мышц. Вследствие данных особенностей строения миокарда возбуждение, возникшее в одном кардиомиоците, с высокой скоростью передается на другие клетки и быстро охватывает миокард целиком. Однако при повреждающих воздействиях на сердце, например в условиях гипотермии, проницаемость каналов в области щелевых контактов резко снижается, что приводит к нарушениям проведения возбуждения в миокарде. Важно также отметить, что большая часть мышечных волокон предсердий и желудочков прикреплена к фиброзной ткани, которая разделяет камеры сердца и электрически изолирует их друг от друга. В результате возможно раздельное последовательное сокращение предсердий и желудочков.
Все клетки миокарда являются высоко дифференцированными и не обладают способностью к делению, поэтому в постэмбриональном периоде жизни человека мышечная ткань сердца не способна к регенерации и процессы рабочей гипертрофии миокарда развиваются за счет увеличения размеров и объема отдельных кардиомиоцитов, а не их общего количества (гиперплазии). В случае некроза участка миокарда (инфаркта), например при ишемической болезни сердца, поврежденный участок замещается соединительной тканью, что приводит к формированию рубца. Поэтому при лечении инфаркта миокарда перспективным является использование стволовых клеток. Указанные клетки при их введении непосредственно в миокард под влиянием клеточных факторов роста могут превращаться в кардиомиоциты и восполнять, таким образом, утраченную сократительную функцию участка миокарда. Однако широкое применение клеточных технологий в клинической практике требует наличия дорогостоящего высокотехнологичного оборудования и проведения дополнительных клинических исследований.
1.2. Происхождение автоматии сердца
Со времен анатомических исследований, выполненных в эпоху Возрождения, и практически до конца XIX в. в физиологии оставался нерешенным вопрос о причинах сокращений сердца, то есть вопрос о том, обусловлены ли они нервными влияниями (нейрогенный механизм) или же являются собственными свойствами сердечной мышцы (миогенный механизм). Еще Леонардо да Винчи писал: «…Проследи нервы до сердца и посмотри, сообщают ли они движение сердцу или оно движется само собой». Исследования, выполненные на беспозвоночных животных, показали, что у многих из них – насекомых, ракообразных, моллюсков – электрические импульсы, запускающие сокращения сердца, возникают в нервных клетках ганглия, расположенного в толще стенок венозного конца сердца или на поверхности последнего. Однако, как было установлено уже к началу XX в., причина сокращения сердца позвоночных животных зависит от собственного миогенного механизма. Следовательно, нейрогенная гипотеза автоматии сердца, справедливая в отношении многих беспозвоночных животных, неприменима к человеку.
Читать дальшеИнтервал:
Закладка: