Герман Хакен - Тайны природы. Синергетика: учение о взаимодействии
- Название:Тайны природы. Синергетика: учение о взаимодействии
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2003
- ISBN:5-93972-230-
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Герман Хакен - Тайны природы. Синергетика: учение о взаимодействии краткое содержание
Для самого широкого круга читателей.
Тайны природы. Синергетика: учение о взаимодействии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Что такое неупорядоченность?
Каким образом мы можем дать определение понятия «неупорядоченность»? В данном случае значение физического термина не так уж далеко от смысла слова, которым мы с вами пользуемся в повседневной жизни — «непорядок, отсутствие порядка, беспорядок». Отчего, например, в комнате школьника беспорядок? Допустим, потому, что здесь давно не прибирали или, иначе говоря, отдельные вещи и вещички (вроде школьных тетрадей и учебников) лежат вовсе не там, где им, собственно, отведено место (рис. 2.3). Скажем, учебник биологии не стоит, как ему положено, на книжной полке, а лежит на столе, или на подоконнике, или на стуле, или на кровати, или на полу, или еще где-то — возможностей у него великое множество. То же самое может относиться к тетрадям, пеналу или ластику.

Рис. 2.3. Так художник М. Эшер представил порядок и хаос. Очевидно, хаос — это такое состояние, при котором ничто не находится в предназначенных местах (а находится, например, в мусорной корзине)
Если же все предметы находятся именно там, где для них предусмотрено место, то состояние такой прибранной комнаты мы называем порядком. Таким образом, возможно только одно состояние порядка, в то время как беспорядок связан с множеством возможностей для каждого предмета оказаться там или сям; вот именно поэтому в отсутствие порядка так трудно бывает отыскать какую-то определенную вещь. Итак, подчеркнем это еще раз: большое количество возможных мест пребывания для каждого предмета и порождает состояние беспорядка.
Описанное множество возможностей определяет меру неупорядоченности и в физике. Мы можем наглядно продемонстрировать это, использовав простой пример. Рассмотрим модель газа, состоящую всего из четырех молекул, которые мы обозначим цифрами от 1 до 4. Допустим, что мы должны распределить этот газ по двум камерам.
Существует всего одна возможность поместить все молекулы в одну камеру (на рис. 2.4 вверху слева) и целых шесть различных вариантов того, как это можно сделать, распределив молекулы попарно по двум камерам. На макроскопическом уровне мы имеем, собственно, всего два варианта: в одном случае все молекулы находятся в одной камере, а во втором — поделены пополам и находятся в разных камерах. Принцип Больцмана гласит, что природа стремится к таким состояниям, при которых имеется наибольшее количество осуществимых вариантов. Используемое физиками понятие «энтропия» определяется, по Больцману, количеством таких возможностей, а говоря точнее, логарифмом этого числа. Итак, природа стремится к состоянию максимальной энтропии.
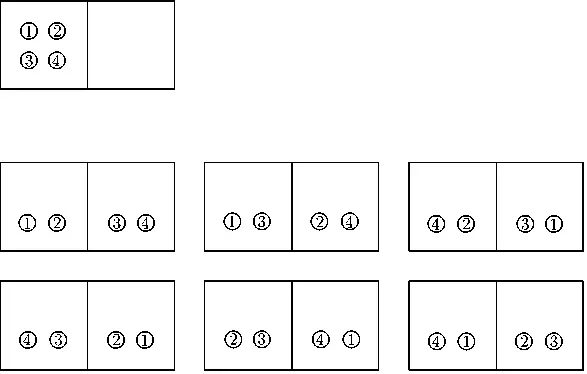
Рис. 2.4. Демонстрация принципа вычисления наибольшей энтропии по Больцману. В верхней части рисунка показан единственный вариант размещения всех молекул в одной камере. Ниже приведены шесть вариантов равномерного распределения газа в двух камерах
В нашем примере шесть вариантов «равномерного распределения четырех молекул» противопоставлены единственному варианту «все молекулы в одной камере». В природе количество молекул газа даже в одном кубическом сантиметре колоссально велико; соответственно многократно возрастает и число возможных вариантов распределения этих молекул. Следовательно, и вероятность того, что природа осуществит вариант равномерного распределения, чрезвычайно высока, и все отклонения от этого варианта представляют собой лишь незначительные флуктуации — например небольшое изменение плотности (рис. 2.5).

Рис. 2.5. На схеме представлена так называемая кривая распределения для случая с очень большим количеством молекул газа. Максимум кривой соответствует состоянию, в котором молекулы равномерно распределены по обеим камерам. Вероятность иного распределения, как видно из графика, чрезвычайно мала.
Разумеется, для достижения полного понимания принципа Больцмана процессы следует рассматривать в движении. Это, собственно, относится уже к вычислению тех вариантов, которые могут быть осуществлены. Если посмотреть на письменный стол, скажем, некоего профессора, то нам может показаться, что здесь царит полный беспорядок. Однако стоит только кому-нибудь (например уборщице) навести на этом столе порядок, профессор будет весьма рассержен: теперь он оказывается просто не в состоянии отыскать на собственном столе и одной из нужных ему бумаг, хотя до сих пор — до наведения этого якобы порядка — ему с легкостью удавалось быстро найти все необходимое. В чем же тут дело? Может быть, это просто каприз старого чудака? Или его затруднения имеют какую-то реальную причину?
Объясняется все следующим образом. Профессор точно знал, где на его столе, который непосвященным казался царством беспорядка, лежат нужные книги и рукописи. Поэтому, несмотря на кажущийся беспорядок, здесь — как и в примере с газом — все же существовало лишь единственное состояние, при котором профессор легко находил свои вещи. После «наведения порядка» это состояние было заменено новым, при котором профессор уже не смог найти нужные ему бумаги на «правильных» местах. Таким образом, в понятие неупорядоченности входит также и случай, когда постоянно реализуются все новые и новые возможности, о которых уже шла речь в примере с молекулами; иными словами, письменный стол профессора разупорядочен, если вещи, находящиеся на нем, без конца меняются местами.
Как раз так и поступает Природа с молекулами газа: двигаясь со скоростью 460 метров в секунду (скорость молекул кислорода при комнатной температуре), они безостановочно проносятся перед нами, осуществляя все новые и новые варианты распределения. Природа похожа на карточного игрока, который с необычайной скоростью перемешивает у нас на глазах колоду, и мы оказываемся уже не в состоянии проследить за какой-либо отдельной картой. Упомянутое движение молекул и само является неупорядоченным: его называют также тепловым движением.
Деградация энергии
Вновь воспользовавшись для примера автомобилем, можно сформулировать то же самое несколько иначе. Пока автомобиль едет, вся его энергия является энергией поступательного движения, или кинетической энергией. Поскольку поступательное движение направленно в определенную сторону, движущийся автомобиль, как говорят физики, имеет одну степень свободы. Когда автомобиль начинает тормозить, его энергия движения преобразуется в тепловую, и его тормозные колодки и покрышки колес нагреваются (рис. 2.6). Однако теплота — это микроскопическое движение огромного количества молекул и атомов. Общеизвестно, что одно тело теплее другого тогда, когда молекулы первого движутся интенсивнее, чем молекулы другого. Но так как молекулы — по крайней мере на микроскопическом уровне — могут двигаться в различных направлениях и количество самих молекул чрезвычайно велико, тепловая энергия характеризуется множеством степеней свободы. Иначе говоря, при торможении автомобиля энергия с единственной степенью свободы становится энергией со многими степенями свободы, и при этом появляется неимоверное количество возможностей реализовать такое новое распределение. Обратный процесс означал бы, что все молекулы разом, как по команде, вдруг самопроизвольно полетели бы в одном направлении, и все множество степеней свободы свелось бы к од-ной-единственной. Однако такое развитие событий — согласно основному закону термодинамики — невозможно. Действительно, энергию поступательного движения автомобиля, т. е. энергию с одной степенью свободы, можно превратить в тепло; обратный же процесс мы осуществить не в состоянии — по крайней мере в полном объеме. Все дело в том, что энергия, заключенная в рамки единственной степени свободы, является энергией более высокого уровня, нежели энергия, распределяемая по множественным степеням свободы.
Читать дальшеИнтервал:
Закладка:










