Герман Хакен - Тайны природы. Синергетика: учение о взаимодействии
- Название:Тайны природы. Синергетика: учение о взаимодействии
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2003
- ISBN:5-93972-230-
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Герман Хакен - Тайны природы. Синергетика: учение о взаимодействии краткое содержание
Для самого широкого круга читателей.
Тайны природы. Синергетика: учение о взаимодействии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
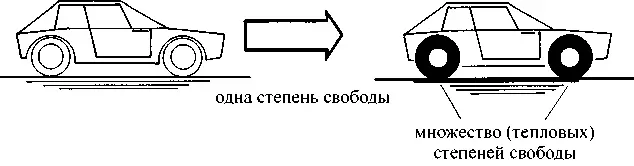
Рис. 2.6. Движущийся автомобиль (слева) имеет только одну степень свободы. При торможении эта единственная степень свободы преобразуется в огромное множество степеней свободы теплового движения (например в покрышках колес и тормозных колодках)
Стремление Природы к возрастающей неупорядоченности может быть определенным образом ограничено. Используя в примере с газом разделяющую камеры перегородку, мы можем воспрепятствовать дальнейшему движению молекул и остановить их дальнейшее распределение. Следует постоянно помнить о том, что Природа не вынужденно стремится к увеличению неупорядоченности, что она вовсе не обязана непременно достичь состояния хаоса, и что на нее извне могут быть наложены ограничения. Так, например, человеку удалось обнаружить несколько технических трюков, с помощью которых стало возможным использование части тепловой энергии. Скажем, в двигателях внутреннего сгорания упомянутая возможность реализуется с помощью движущихся поршней: часть образующейся при сгорании бензина тепловой энергии переходит в энергию, которая движет поршни, располагающие одной степенью свободы; однако большая часть тепловой энергии при этом все же теряется — точнее, передается охлаждающей жидкости. Как утверждает физика, подобная «регенерация» и вторичное использование высокоуровневой энергии принципиально ограничено и требует к тому же особых машин, придуманных человеческими головами и созданных человеческими руками. Во Вселенной для возрастающей неупорядоченности, по-видимому, не существует такого рода препятствий. Отсюда физики заключают, что Вселенная устремлена к состоянию максимальной неупорядоченности, при котором все упорядоченные структуры в конце концов распадутся и жизнь станет невозможна — Вселенную ждет «тепловая смерть». Вспомним слова знаменитого Г. фон Гельмгольца (1821-1894): «С этого момента Вселенная обречена на вечный покой». А не менее знаменитый Р. Клаузиус (1822-1888) говорил: «Чем ближе Вселенная к состоянию максимальной энтропии, тем меньше возникает возможностей для дальнейших изменений». Когда же это состояние будет достигнуто, Вселенная окажется «в состоянии неизменной смерти».
Взгляд в прошлое Вселенной дает нам, по всей видимости, столь же мало указаний на возможность возникновения жизни, как и взгляд в ее будущее. По оценкам большинства физиков, Вселенная возникла порядка 10-15 миллиардов лет назад в результате «большого взрыва» в виде чудовищно горячего огненного шара, внутри которого не было и следа порядка. Итак, в начале времен в мире не существовало ничего, кроме хаоса. После этого неупорядоченность должна была только возрасти, стремясь достичь максимума. Где же среди всего этого хаоса нашлось место для упорядоченных, осмысленных — не говоря уже о живых — структур?
Глава 3 КРИСТАЛЛЫ: УПОРЯДОЧЕННЫЕ, НО НЕЖИВЫЕ СТРУКТУРЫ
В предыдущей главе упоминалось о том, что повышение температуры связано с более интенсивным движением молекул и, соответственно, приводит к большей неупорядоченности. Это наводит на такую мысль: нельзя ли добиться упорядоченности, избавляя систему от тепловой энергии. Именно это и происходит при охлаждении. Рассмотрим несколько эмпирических фактов. Если заморозить воду, то она превратится в лед, а точнее — образует ледяной кристалл (рис. 3.1).
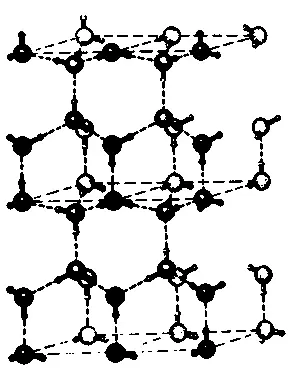
Рис. 3.1. В кристалле льда молекулы воды строго упорядочены и создают периодическую решетку, схематически изображенную на этом рисунке. Большими шарами представлены атомы кислорода, а соединенные с ними сплошными линиями маленькие шарики символизируют атомы водорода
Поскольку молекулы воды очень и очень малы (приблизительно одна миллионная миллиметра), мы не можем увидеть их по отдельности даже при помощи самого лучшего микроскопа, однако кристаллы можно «прощупать», используя рентгеновское излучение или электронные волны, благодаря чему физики и получили столь точную картину их строения. Отдельные молекулы выстроены в кристалле стройными рядами, «плечом к плечу»: здесь мы имеем дело с высокоорганизованным твердым состоянием материи. В жидком состоянии отдельные молекулы воды подвижны относительно друг друга, что и обеспечивает ее текучесть. Если нагреть воду до температуры кипения, она начнет испаряться, т. е. перейдет в газообразное состояние. В водяном паре молекулы воды непрерывно сталкиваются друг с другом и изменяют вследствие этого траектории своего движения, подобно множеству крошечных теннисных мячей — т.е. находятся в состоянии полной неупорядоченности (рис. 3.2).
Рис. 3.2. Три агрегатных состояния воды
В физике эти различные агрегатные состояния — твердое, жидкое и газообразное — называют также фазами, а переходы от одного состояния к другому, соответственно, фазовыми переходами. Благодаря тому, что для возникающих при фазовых переходах состояний характерны совершенно различные уровни упорядоченности (или неупорядоченности), такие переходы давно привлекли к себе внимание физиков; исследования фазовых переходов проводятся и современными учеными. Что же особенного в фазовых переходах?
Как уже ясно из примера с водой, основу каждой из трех фаз — водяной пар, вода и ледяной кристалл — составляют одни и те же молекулы. На микроскопическом уровне эти три фазы отличаются только лишь организацией молекул, их расположением относительно друг друга. В водяном паре молекулы движутся со скоростью около шестисот двадцати метров в секунду, при этом молекулы никоим образом не воздействуют друг на друга (за исключением случаев их столкновения). В жидкости между молекулами существуют силы взаимного притяжения, однако молекулы все же остаются довольно подвижными. В кристаллах же отдельные молекулы жестко упорядочены внутри периодической решетки (рис. 3.3).
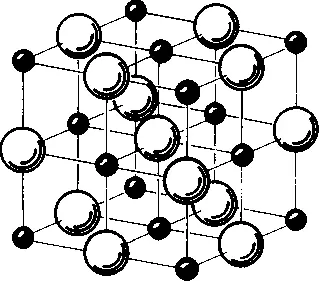
Рис. 3.3. Организация атомов в кристалле поваренной соли (NaCl). Большие шары — ионы хлора, маленькие — ионы натрия
С каждым из этих состояний микроскопической организации связаны совершенно различные макроскопические свойства, особенно же наглядно проявляются различия механических свойств. Например, в газообразной (или парообразной) фазе вещество легко сжимается, в то время как жидкость почти несжимаема, а лед и вовсе является твердым телом. Изменяются и другие физические свойства — к примеру светопроницаемость. Таким образом, мы видим, что микроскопические изменения могут стать причиной появления совершенно новых макроскопических свойств вещества (любого вещества, а не только воды).
Читать дальшеИнтервал:
Закладка:










