Валерий Савченко - Начала современного естествознания: концепции и принципы
- Название:Начала современного естествознания: концепции и принципы
- Автор:
- Жанр:
- Издательство:«Феникс»
- Год:2006
- Город:Ростов-на-Дону
- ISBN:5-222-09157-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Валерий Савченко - Начала современного естествознания: концепции и принципы краткое содержание
В данном пособии самым подробным образом рассмотрены основные естественноисторические этапы становления и развития науки, вопросы философии науки и естествознания, фундаментальные концепции, принципы и положения классического механистического и термодинамического, неклассического полевого и квантово-полевого и постнеклассического эволюционно-синергетического и диссипативно-структурного естествознания. Рассмотрены вопросы связи математики и отражаемой ей естественнонаучной реальности мира. В конце каждой главы и некоторых наиболее сложных параграфов даны резюме, предложены вопросы для обсуждения. Дано около 400 тем рефератов и свыше 400 тестовых вопросов для контроля усвоения и аттестации теоретического материала пособия.
Предназначено для студентов очной и заочной форм обучения гуманитарных и социально-экономических специальностей вузов, а также для обучающихся по дистанционным технологиям. Пособие может быть полезно преподавателям данной учебной дисциплины и широкому кругу лиц других специальностей и профессий, в том числе, студентам естественнонаучных и инженерно-технических специальностей, всем, интересующимся вопросами истории, становления и развития классического, неклассического и постнеклассическтого естествознания, а также проблемами естествознания новейшего времени и его ролью в развитии науки и культуры.
Начала современного естествознания: концепции и принципы - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Обратные процессы, переводящие систему из более вероятного состояния в менее вероятное, самопроизвольно не протекают. Такие процессы могут быть возможны только при определенном, специфически организованном подводе энергии из какого-либо внешнего источника. С такими процессами человек познакомился с изобретением паровой машины — первой машины, для преобразования хаотического движения в организованное — именно, тепла в работу. Как уже упоминалось, Карно доказал, что такое преобразование не может быть полным — часть тепловой энергии обязательно должна быть диссияирована, рассеяна (отдана холодильнику). Отсюда следует еще такой кельвинский вариант формулировки второго начала термодинамики: невозможен процесс, единственным результатом которого было бы поглощение теплоты от нагревателя и полное преобразование этой теплоты в работу.
Итак, второе начало термодинамики позволяет разделить все процессы на естественные — переход работы в тепло, самопроизвольный переток тепла от горячего тела к холодному — и на противоестественные.
Далее мы рассмотрим достаточно сложные в естествознании понятия энтропии, энтальпии, негэнтропии, свободной энергии, характеризующие тепловые или термодинамические процессы, процессы обмена энергией, веществом в больших природных системах, отнеся вопросы энергетики в живых системах в раздел о концепциях и принципах биологического естествознания, (глава 9). Знание таких понятий и процессов необходимы для понимания явлений химического и биологического типов, характеризующихся, практически на всех стадиях своего развития, самоорганизацией и эволюцией. В некоторых случаях мы будем употреблять для иллюстрации формулы, которые нет необходимости запоминать.
Понятие энтропии (от греч. еп — в, внутри + trope — поворот, превращение) как меры внутренней неупорядоченности системы было введено Клаузиусом следующим
образом: 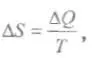 где приращение энтропии системы
где приращение энтропии системы 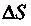 связано с увеличением количества тепла
связано с увеличением количества тепла 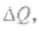 получаемого системой, а сам переход системы из одного состояния в другое происходит обратимым образом, Т — температура системы.
получаемого системой, а сам переход системы из одного состояния в другое происходит обратимым образом, Т — температура системы.
Любой самопроизвольно протекающий в замкнутой изолированной системе процесс должен увеличивать эту величину. Рассмотрим, например, как будет меняться эта величина при выравнивании температур в неравномерно нагретом теле. При этом процессе некоторое количество тепла перейдет от горячей части к холодной — одна часть теряет (рассеивает), а другая приобретает одно и то же количество тепла. Энергия системы не изменится, но горячая часть системы потеряет тепло при большей температуре Т1, чем холодная при температуре Т2 ее приобретет, и, значит, потеря энтропии горячей частью будет меньшей, чем ее увеличение в холодной — энтропия всей системы возрастет: 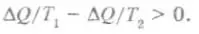
Энтропия кажется, и не без оснований, весьма загадочной и непривычной характеристикой состояния термодинамической системы, но на самом деле она несколько иная характеристика системы, чем энергия, и столь же полноправная. Если энергия — это мера некоторой потенциальной возможности системы совершить полезную работу, то есть упорядоченное действие, то энтропия — это мера качества энергии, то есть реальной способности ее произвести работу без привлечения внешнего воздействия. Энтропия возрастает при рассеянии энергии, при возрастании неупорядоченности системы, при возрастании хаоса.
Статистическое определение энтропии было дано впервые австрийским физиком Людвигом Больцманом (1844–1906 гг.). Он связал энтропию системы с вероятностью макроскопического состояния системы 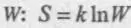 , где k — так называемая постоянная Больцмана, равная отношению универсальной газовой постоянной R к числу Авогадро N A. Величина W представляет собой число способов, которыми можно осуществить (создать, организовать) данную систему, и эта величина определяет вероятность реального ее осуществления (организации). Любая упорядоченность, возникающая в системе, ограничивает число ее возможных конфигураций, уменьшает вероятность ее существования в таком виде и энтропию. Перемешивание, пространственное выравнивание концентраций увеличивает число вариантов взаиморасположений конкретных молекул, обеспечивающих данную конфигурацию, а увеличение температуры или выравнивание ее увеличивает число вариантов распределения энергии между частицами системы (молекулами), обеспечивающих данную среднюю энергию.
, где k — так называемая постоянная Больцмана, равная отношению универсальной газовой постоянной R к числу Авогадро N A. Величина W представляет собой число способов, которыми можно осуществить (создать, организовать) данную систему, и эта величина определяет вероятность реального ее осуществления (организации). Любая упорядоченность, возникающая в системе, ограничивает число ее возможных конфигураций, уменьшает вероятность ее существования в таком виде и энтропию. Перемешивание, пространственное выравнивание концентраций увеличивает число вариантов взаиморасположений конкретных молекул, обеспечивающих данную конфигурацию, а увеличение температуры или выравнивание ее увеличивает число вариантов распределения энергии между частицами системы (молекулами), обеспечивающих данную среднюю энергию.
Обратимся теперь, кратко, к понятиям замкнутых систем (которые могут обмениваться с окружающей средой энергией, но не веществом) и открытых систем (могут обмениваться и энергией и веществом), чтобы завершить формулирование еще некоторых понятий термодинамики.
Для замкнутых систем, находящихся в условиях постоянства температуры и объема, закон возрастания энтропии переходит в закон уменьшения свободной энергии F Гельмгольца, которая определяется равной следующей величине F = E — TS, где Е — полная энергия.
В случае же постоянных температур и давления, закон возрастания энтропии переходит в закон убывания свободной энергии Гиббса Ф: Ф = Н — TS, где Н — так называемая энтальпия (от греч. enthalpo — нагреваю), функция независимых переменных — давления и энтропии, однозначно определяющая состояние физической системы. Энтальпия иначе также называется термодинамическим потенциалом.
Для открытых систем переходят к локальной формулировке второго начала термодинамики. Тогда общее изменение энтропии открытой системы DS представляют в виде суммы двух слагаемых: 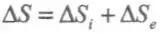 , где
, где 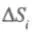 — изменение энтропии, обусловленное внутренними (internal) процессами в системе;
— изменение энтропии, обусловленное внутренними (internal) процессами в системе; 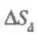 — изменение энтропии системы, обусловленное внешними (external) причинами — контактом со средой. Скорость изменения энтропии
— изменение энтропии системы, обусловленное внешними (external) причинами — контактом со средой. Скорость изменения энтропии 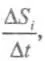 отнесенная к единице объема системы, называется производством энтропии s.
отнесенная к единице объема системы, называется производством энтропии s.
Локальная формулировка второго начала утверждает, что производство энтропии всегда положительно. На более сильном утверждении о минимуме производства энтропии, Илья Пригожин основал теорию диссипативных структур, одну из современных теорий самоорганизации, наряду с синергетикой, теорией катастроф, автопоэзиса, теорией сложности и др.
Читать дальшеИнтервал:
Закладка: