Паоло Пелоси - Обоняние [Увлекательное погружение в науку о запахах]
- Название:Обоняние [Увлекательное погружение в науку о запахах]
- Автор:
- Жанр:
- Издательство:Литагент Аттикус
- Год:2020
- Город:Москва
- ISBN:978-5-389-19087-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Паоло Пелоси - Обоняние [Увлекательное погружение в науку о запахах] краткое содержание
«Мы часто не обращаем внимания на запахи и почти всегда их недооцениваем. Между тем они тайно влияют на наше настроение, предопределяют выбор и вообще делают жизнь куда более приятной. Наш нос непрерывно бомбардируют разнообразные молекулы, даже если мы ничего не нюхаем специально. Агрессивные запахи нас отталкивают и нередко спасают от потенциально опасных ситуаций, приятные кажутся неодолимо привлекательными, и зачастую все это происходит исподволь, так, что мы ничего не осознаем. Ароматы вызывают эмоции и внезапно возвращают к жизни воспоминания, давно спрятанные в глубинах памяти» (Паоло Пелоси).
Обоняние [Увлекательное погружение в науку о запахах] - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Охота за новым рецептором обычно подразумевает несколько шагов. Прежде всего вам нужен надежный, быстрый и недорогой (в плане образцов) тест, способный измерить активность, а следовательно, наличие изучаемого рецептора. Скажем, лекарство или химическое вещество вообще вызывает наблюдаемую и измеряемую реакцию у индивидуума или изолированного органа. Далее вы маленькими порциями меняете структуру молекулы и смотрите, как это влияет на качество и интенсивность продуцируемого сигнала.
Говоря в общем, белок-рецептор сидит на мембране клетки (предположим, нейрона) и посылает внутрь нее информацию о присутствии посторонней молекулы. Задача экспериментатора – изолировать такой белок и изучить его характеристики. В некоторых случаях молекулу, узнанную белком-рецептором, используют как наживку, чтобы «выловить» рецептор: он связывается с веществом, и его удается изолировать от прочих химикатов и белков, содержащихся в смеси [2].
Примерно такие же техники использовались гораздо раньше для изучения ферментов. Фермент – это тоже белок, который, подобно рецептору, связывается с химическим соединением, но затем вступает с ним в реакцию, модифицирует структуру и выпускает продукт взаимодействия (см. рис. 21). Этот цикл можно повторять многократно с одной и той же молекулой фермента, причем с усилением эффекта – в данном случае химического выхода. Накопление больших количеств выходного продукта, полученных при помощи крошечных количеств фермента, делает изучение этих веществ сравнительно легким: относительно просто выдержать исходный ферментный субстрат достаточно долгое время, позволяя реакции идти своим чередом и дожидаясь той концентрации выхода, которую можно будет с легкостью измерить.
Когда простой и надежный метод, позволяющий определить присутствие фермента, наконец установлен, фермент нужно изолировать и очистить от грубого биологического экстракта путем фракционирования. В каждом таком случае мы получаем набор пробирок, содержимое которых затем анализируется на предмет наличия в нем искомого фермента. Те, в которых он есть, соединяются и подвергаются второму этапу очищения – и так далее, и так далее, пока не останется никаких других белков, кроме нашего фермента.
В случае с белком-рецептором процедура будет похожая, хотя найти способ определять наличие связывающего свой лиганд, но не производящего никакой реакции белка будет труднее (см. рис. 21). Было разработано несколько протоколов, но все они довольно сложны и при этом недостаточно точны. В классическом методе еще используются радиоактивно маркированные вещества, особенно когда лиганд – маленькая органическая молекула.
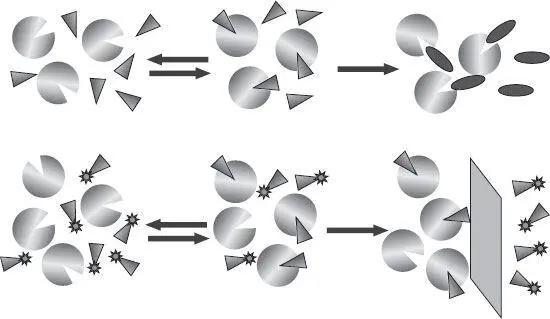
Рисунок 21.Разница между ферментами и рецепторами. Верхняя часть диаграммы показывает молекулы фермента (круги), которые обратимо связывают субстрат (треугольники) и превращают его в выходной продукт (эллипсы). Активность фермента легко измеряется посредством наблюдения за объемом выхода. В случае с рецептором не происходит никакой реакции (нижняя часть диаграммы). Связывающую активность можно измерить только после отделения белка от свободного лиганда. Если промаркировать лиганд, например, радиоактивной меткой, можно будет просто сравнить радиоактивность обеих фракций и оценить сродство лиганда и рецептора.
Раствор, содержащий рецептор, который мы хотим проанализировать, смешивается с радиоактивным лигандом до состояния равновесия. На этом этапе часть лиганда уже связана белком-рецептором, а часть остается свободной в растворе. Пропорция между двумя концентрациями зависит от сродства рецептора лиганду. Как же нам измерить концентрации свободных и связанных лигандов? Нужно прежде всего отделить свободный лиганд от связанного белком. Для этого применяются разные техники фракционирования по молекулярной массе. Свободный лиганд окажется во фракции с низкой молекулярной массой, а связанный отправится вместе с белком во фракцию с высокой. Такими методами ученые пользовались в конце 1970-х для идентификации и изоляции белков-рецепторов. Тогда их занимали в основном рецепторы гормонов (в особенности стероидов) и нейротрансмиттеров – такие как ацетилхолиновый или β-адренэргический.
Принимая гипотезу, что ольфакторные рецепторы, как и рецепторы всяких других молекул, являются белками, невольно задаешься вопросом: что же заставило биохимиков так долго чураться этой новой интересной области научного знания? Казалось бы, они вечно ищут новые идеи, новые неизведанные территории. Кто из них не мечтает первым открыть новую молекулу, закон физики или необычный физиологический эффект?
Основная причина заключалась, скорее всего, в том, что всякая новая область исследований означает огромный риск. На ученую братию постоянно давит необходимость публиковаться, чтобы в будущем иметь возможность запрашивать финансирование; для оригинальных новаторских проектов зачастую просто нет места. А при подаче на финансирование всегда важно заявлять проект, твердо стоящий на ногах и обещающий на выходе конкретные, практически применимые результаты. Новый проект, основанный исключительно на идеях, имеет исчезающе малые шансы получить деньги.
Ну и конечно, биохимики не торопились углубляться в сферу обоняния по той простой причине, что там все очень уж сложно устроено. Даже при тогдашних ограниченных знаниях опытные химики не могли не догадываться, что ольфакторная система – не чета простому зрительному коду и должна быть основана на огромном количестве рецепторов. А вот количество белков-рецепторов каждого типа, напротив, должно быть очень невелико. Таким образом, биохимики, желающие посвятить свою жизнь ольфакции, столкнулись бы с серьезной задачей – не только идентифицировать один-единственный специфический белок, присутствующий в крошечных количествах (заметно ниже порога чувствительности тогдашних инструментов и техник), но и сепарировать его от сотен других структурно схожих белков. Средств для решения такой задачи у науки не было.
Учитывая такое положение дел в конце 1970-х, отсутствие интереса к охоте на ольфакторные рецепторы на белковом уровне не должно никого удивлять. Фактически было предпринято всего несколько попыток, да и те оказались безуспешными. В любом случае результаты, полученные в единичных лабораториях, никто не повторил и не подтвердил, а вскоре они и вовсе утратили надежность и достоверность в глазах научного сообщества.
Сегодня, в свете новых знаний, полученных благодаря продвинутым техникам молекулярной биологии, задача эта для тех времен представляется совершенно безнадежной. Рецепторы мембраны составляют слой на поверхности клетки толщиной в одну молекулу, то есть количественно их гораздо меньше, чем белков внутри самой клетки. Вдобавок в одном образце ткани содержится очень много белков-рецепторов с очень похожими свойствами.
Читать дальшеИнтервал:
Закладка:
![Обложка книги Паоло Пелоси - Обоняние [Увлекательное погружение в науку о запахах]](/books/1061157/paolo-pelosi-obonyanie-uvlekatelnoe-pogruzhenie-v.webp)



![Паоло Бачигалупи - Орудие войны [litres с оптимизированной обложкой]](/books/1094305/paolo-bachigalupi-orudie-vojny-litres-s-optimiziro.webp)



