Алексей Данилов - Популярная аэрономия
- Название:Популярная аэрономия
- Автор:
- Жанр:
- Издательство:Гидрометеоиздат
- Год:1979
- ISBN:5-286-00171-8
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Алексей Данилов - Популярная аэрономия краткое содержание
Книга рассчитана на специалистов в области метеорологии, физики ионосферы и распространения радиоволн, солнечно-земной физики, физики ионно-атомных столкновений, аспирантов и студентов вузов.
Популярная аэрономия - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Так может, подобное же происходит и с азотом? Может, зарегистрированные масс-спектрометрами относительно высокие концентрации N есть лишь отражение эффективно идущей диссоциации N2?
 Диссоциация N2
Диссоциация N2
Оказывается, нет. Молекулу N2 мы не раз называли "ленивой" за ее нежелание вступать в различного рода реакции. Не изменила она себе и в этом случае. Молекулярный азот активно не хочет подвергаться диссоциации солнечным излучением. В этом отношении он полностью игнорирует пример своего коллеги молекулярного кислорода. Если для O2 коэффициент диссоциации составляет около 10-5 с-1 (вероятность диссоциации под действием солнечного излучения в расчете на одну молекулу), то для N2 эта величина равна всего лишь 10-12 с-1. Разница, как видите, весьма внушительная - в миллион раз.
Простой расчет показывает, что если бы в атмосфере действовала только диссоциация N2 солнечным излучением (так называемая фотодиссоциация), то концентрации атомов азота в верхней атмосфере были бы ничтожно, неизмеримо малы.
На самом деле на помощь фотодиссоциации приходит диссоциация N2 в результате цикла ионных реакций. Действительно, посмотрите на эти реакции, о которых мы говорили в главе 4:
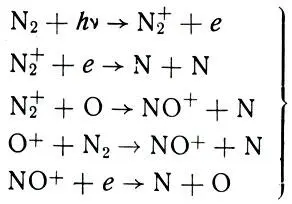 Формула 47
Формула 47
Здесь в левой части в качестве исходных материалов стоит N2 или полученные из него ионы N2+ и NO+. А в правой части в качестве получаемых продуктов - атомы N. Таким образом, ионизационно-рекомбинационный цикл процессов выше 100 км непрерывно и неуклонно ведет к важному побочному результату - перемалыванию молекул N2 в атомы N. Так, молекула N2, которая, как мы видели, успешно сопротивляется фотодиссоциации, не в силах устоять перед более мощным механизмом диссоциации в ионных реакциях.
Итак, механизм диссоциации N2 нам теперь известен. Можем ли мы, не вдаваясь в детали, оценить скорость диссоциации N2, а значит, и скорость образования N? Оказывается, можем. Выше некоторого уровня основными ионами, образующимися в процессе ионизации, являются ионы N2+ и О+. Но именно эти ионы в ходе описанных выше реакций и приведут к преобразованию N2 в N. Значит, практически почти каждый акт ионизации ведет к разрушению одной молекулы азота N2 и к образованию взамен двух атомов N. И мы можем в первом приближении положить, что скорость образования N равна удвоенной общей скорости ионизации g. На самом деле (за счет добавки ионов О2+, которые не приводят к диссоциации N2) эта скорость несколько меньше, чем 2g, и уж, конечно, никогда не может быть больше.
Скорости ионизации нам известны достаточно хорошо. Мы можем положить, что на выбранной нами высоте величина 2g заведомо не превышает 4×103 см-3×с-1. Сравнивая это значение с полученной выше величиной [N][NO]α2 = 104÷105 см-3-с-1, мы приходим к неутешительному выводу, что и с точки зрения скорости образования атомов N последняя величина слишком (на порядок!) высока. Общепринятого решения проблемы [N] пока не существует. Автор считает, что правильны принятые концентрации окиси азота и необходимо отказаться от высоких, значений [N], получаемых в ряде масс-спектрометрических измерений.
В пользу этого говорит еще и то, что в последнее время появились (пока качественные) идеи объяснения высоких значений I14/I28 в масс-спектрометрических экспериментах. Как мы помним, в лаборатории при калибровке измеряют отношение I14/I28, с которым сравнивают потом измерения в атмосфере.
А что - возникает вопрос - если молекулы атмосферного азота легче распадаются в масс-спектрометре N и N+, чем молекулы лабораторного газа, потому что первые находятся в возбужденном состоянии, а вторые - нет? Ведь мы еще очень мало знаем о состоянии возбуждения атмосферного газа. И вполне можем предположить, что (по крайней мере в случае N2) процент возбужденных частиц достаточно велик. А возбужденные частицы в силу запасенной в них внутренней энергии должны быть более "податливы" к разрушению под внешним воздействием (в нашем случае - под действием электронов ионного источника), чем невозбужденные. Не в этом ли разгадка проблемы высоких I14/I28?
Это пока всего лишь идея, не нашедшая количественного решения. Однако она тем более завлекательна, что в случае удачи мешающие всем высокие значения I14/I28 могут стать отличным индикатором состояния возбуждения одной из важнейших компонент верхней атмосферы - молекулярного азота.
Возбужденные частицы - жители эксайтсферы
В аэрономию все активнее вторгается термин "возбужденные частицы", или "возбужденные специи". Обсуждают химию возбужденных частиц, строят их распределение по высоте, изучают их влияние на различные процессы в верхней атмосфере...
Что же такое возбужденные частицы и почему они привлекают сейчас такое внимание?
Все, о чем рассказывалось до сих пор в этой книге, относилось в подавляющем числе случаев к распределению и физикохимии обычных, невозбужденных атомов и молекул, или, как говорят, частиц в основном состоянии. Это означает, что частицы, о которых идет речь, не имеют другой энергии, кроме обычной кинетической энергии их движения.
Но из физики нам известно, что атомы и молекулы могут обладать кроме кинетической энергии и внутренней энергией, которую они запасают, возбуждаясь на разные уровни в результате различных процессов. Уже на заре исследований верхней атмосферы стало ясно, что возбужденные частицы существуют и в атмосферном газе. Доказательством этого задолго до первых ракетных и спутниковых экспериментов послужило наблюдение собственного свечения атмосферы в различных условиях: ночью, в сумерках, во время полярных сияний. Дело в том, что запасенную внутреннюю энергию возбужденный атом или молекула могут расходовать по-разному. Эта энергия в результате столкновений может быть потрачена на разогрев окружающего газа, образование другой возбужденной частицы в результате химической реакции или перейти в излучение. В последнем случае наш атом (или молекула) излучит квант света. При этом частицы данного сорта в данном состоянии возбуждения могут испустить только квант излучения определенной длины волны. Скажем, атом кислорода в возбужденном состоянии 1S всегда будет давать излучение только с длиной волны 5577 Å (это и есть известная зеленая линия атомного кислорода в свечении ночного неба и полярных сияний), а молекула кислорода в состоянии 1Δg- только излучение в инфракрасной области с длиной волны около 1,27 мк.
Таким образом, линии и полосы излучения являются своего рода "паспортами" различных возбужденных частиц. Именно по этим "паспортам", наблюдая с Земли свечение верхней атмосферы, установили, что в ней существуют возбужденные атомы кислорода в состояниях 1S и 1D, возбужденные молекулы О2 в различных состояниях, наиболее важным из которых, как мы увидим дальше, является состояние 1Δg, возбужденные атомы натрия и возбужденные молекулы гидраксила ОН. У всех этих частиц оказались наиболее ясные "паспорта", поэтому их и отождествили в первую очередь.
Читать дальшеИнтервал:
Закладка:










