Михаил Никитин - Происхождение жизни. От туманности до клетки
- Название:Происхождение жизни. От туманности до клетки
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2016
- Город:Москва
- ISBN:978-5-9614-4350-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Никитин - Происхождение жизни. От туманности до клетки краткое содержание
Происхождение жизни. От туманности до клетки - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Как мы видели выше (табл. 6.1), цинк по общему содержанию в клетках сравним с железом и превосходит все прочие переходные металлы. В известных структурах РНК железо совершенно отсутствует, а цинк встречается чаще других переходных металлов (табл. 6.2). На втором месте – марганец, ведущий себя подобно цинку. Многие рибозимы требуют присутствия ионов металлов для проявления каталитической активности. Среди таких металлов самые распространенные – магний, цинк и марганец, а железо никогда не встречается.
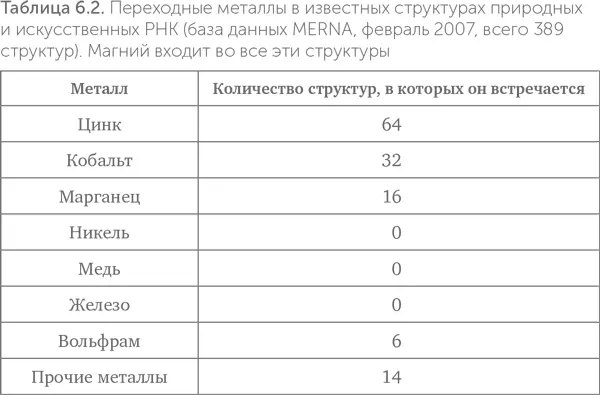
Цинком также обогащены самые древние белки и ферменты с древними функциями. Из 49 универсальных белков (таких, которые присутствовали во всех прочитанных на 2008 год геномах) 37 содержат цинк, 19 – марганец и только 3 – железо. Причем цинк не обязательно нужен для каталитической активности, часто он просто стабилизирует трехмерную структуру. Один из таких древних белковых фолдов (укладок) – ДНК-РНК-связывающий домен, называемый «цинковый палец», где атом цинка связан между двумя остатками цистеина и двумя – гистидина, очень широко распространен, например, среди ДНК-связывающих белков.
Таким образом, можно сказать, что содержание металлов в клетках подтверждает теорию «цинкового мира», а не «железосерного».
В пользу «цинковой» теории говорит еще то обстоятельство, что ионы железа легко расщепляют РНК, связываясь с 2' и 3' гидроксильными группами рибозы. Поэтому клетки хранят избыток железа в связанном виде, вместе с белком ферритином. Вахтерхойзер, чтобы обойти эту сложность, предполагает, что первые нуклеиновые кислоты содержали вместо рибозы четырехуглеродные сахара, такие как эритроза. Подобные ксенонуклеиновые кислоты были получены искусственно, они устойчивы к ионам железа, щелочам и высокой температуре, могут комплементарно соединяться с классическими РНК, но в таком случае непонятно, почему они сменились более уязвимыми нуклеиновыми кислотами с рибозой (подробнее об этом будет рассказано в главе 12).
В целом теория «цинкового мира» находит больше подтверждений, но полностью отвергать роль химических реакций на поверхности пирита нельзя. В конце концов, зоны сульфидов железа и сульфидов цинка соседствуют в одних и тех же геотермальных источниках. Вещества, синтезируемые на сульфиде железа, постепенно смываются и переносятся с током воды и пара в зону сульфида цинка, где могут включаться в происходящие там под действием света процессы. Именно железосерный «нижний этаж» геотермальных источников мог поставлять наверх серосодержащие вещества: карбонилсульфид, меркаптаны, тиоацетат и тиометилацетат. Последний особо важен для биохимии, так как является простейшим аналогом ацетилкофермента А, способного легко присоединять ацетильную группу (CO-CH 3) к другим органическим молекулам (подробнее об ацетилкоферменте А будет рассказано в главе 11).
Фосфорная проблема и пути ее решения
Живые клетки содержат большое количество фосфора. Он входит в состав ДНК, РНК, энергетической «валюты» – АТФ и многих других жизненно важных молекул. Сахара присутствуют в клетках в основном в фосфорилированной форме. Однако в неживой природе фосфор существует практически только в виде фосфатных минералов, таких как апатит Ca 5(PO 4) 3OH, которые нерастворимы в воде и химически инертны. Более того, высокая концентрация растворенного фосфата несовместима с клеточными концентрациями магния и кальция – их фосфаты плохо растворимы и должны выпадать в осадок. В клетке этого не происходит, потому что почти весь внутриклеточный фосфор находится в составе различных фосфорилированных органических молекул, соли которых с магнием и кальцием растворимы.
Как же собрать в колыбели жизни достаточно фосфора, причем в форме, пригодной для получения сахарофосфатов и нуклеотидов? В принципе, возможно несколько решений (рис. 6.6). Например, пирофосфат (P 2O 7 4−) растворим в воде в присутствии кальция и магния и, более того, способен служить источником энергии для биохимических реакций, подобно АТФ. Некоторые микроорганизмы и сейчас используют пирофосфат для тех реакций, которые у других организмов требуют затрат АТФ. Другая растворимая и химически активная форма фосфора – фосфит (HPO 3 2−). Это соединение может окисляться до фосфата с выделением большого количества энергии и давно используется химиками для синтеза искусственной ДНК (Lestinger et al., 1975). Кроме того, многие бактерии обладают ферментами для окисления фосфита и могут использовать его как единственный источник фосфора. Некоторые бактерии даже способны получать энергию из процесса окисления фосфита.
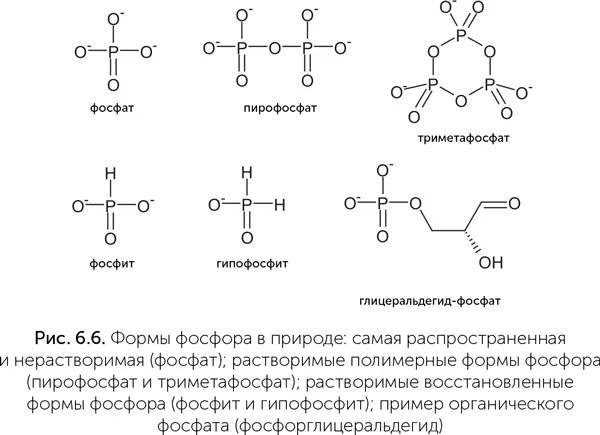
Где и как могли накопиться пирофосфаты или фосфиты в высоких концентрациях? Хорошим источником могут быть метеориты. В двух типах метеоритов (состоящие из железа и силикатов энстатитовые хондриты и железные метеориты) содержится до 0,1–0,5 % минерала шрайберзита (фосфид железа Fe 3P). При попадании в воду шрайберзит постепенно разлагается, выделяя фосфиты, фосфаты, пирофосфаты, оксид железа и водород. До 50 % фосфора из шрайберзита переходит в фосфиты и до 5 % – в пирофосфаты. Фосфит устойчив к ультрафиолетовому излучению, не окисляется в отсутствии катализаторов и может сохраняться в морской воде сотни миллионов лет (Pasek et al., 2008).
Другой источник фосфитов и пирофосфатов – вулканы и связанные с ними наземные геотермальные источники. Измерения японских геохимиков на вулкане Усу (остров Хоккайдо) показали, что в выходящих из фумарол вулканических газах с температурой 540–700 °C содержится заметное количество летучих оксидов фосфора: P 4O 10, PO 2и P 4O 6. При лабораторном моделировании поведения жидкой лавы при температуре 1300 °C оказалось, что до 40 % фосфора из нее улетучивается в виде оксидов (Yamagata et al., 1991). Последующее растворение этих оксидов в воде дает фосфиты и пирофосфаты.
Вода многих наземных геотермальных источников обогащена соединениями фосфора: например, в грязевых котлах Мутновской сопки на Камчатке его концентрация достигает 0,01 % (Bortnikova et al., 2009). В большинстве геохимических анализов геотермальной воды измерялся общий уровень фосфора во всех формах, не различая фосфат, пирофосфат и фосфит, но для горячих источников Мамонтовых озер в Калифорнии показано, что до половины фосфора в их воде содержится в виде фосфита (Pech et al., 2009). В древних вулканических газах и геотермальных водах, скорее всего, содержание всех форм фосфора было еще в несколько раз выше, потому что древнейшие материки, как мы помним из главы 4, были сложены богатыми фосфором KREEP-базальтами.
Читать дальшеИнтервал:
Закладка:







