Михаил Никитин - Происхождение жизни. От туманности до клетки
- Название:Происхождение жизни. От туманности до клетки
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2016
- Город:Москва
- ISBN:978-5-9614-4350-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Никитин - Происхождение жизни. От туманности до клетки краткое содержание
Происхождение жизни. От туманности до клетки - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Прорыв в понимании происхождения этого семейства наметился в 2014 году. Биоинформатики из Техасского университета, используя чувствительные методы поиска сходства белков, нашли дальних родственников семейства НСО (Pei et al., 2014). Молекула НСО обладает несовершенной трехлучевой симметрией: 12 трансмембранных спиралей образуют 3 похожие группы по 4 спирали, расположенные вокруг общего центра. Два гема и один атом меди нарушают симметрию. Среди обнаруженных родственников НСО часть белков имеет 4 трансмембранные спирали, похожие больше всего на 9–12-ю спирали НСО (их назвали НСОН-s, НСО homolog single domain). Такие белки не могут устойчиво свернуться поодиночке, а должны объединяться по три, чтобы получилась трехмерная укладка, похожая на HCO. Если в геноме есть несколько генов HCOH-s, кодируемые ими белки могут объединяться в комплексы смешанного состава из двух субъединиц одного типа и одной – другого.
Судя по наличию связывающих гем остатков гистидина, комплексы из одинаковых субъединиц могут содержать три молекулы гема, а комплексы состава «2+1» – одну. Другие родственники НСО, НСОН-t (НСО homolog triple domain) состоят из 12 спиралей, уложенных так же, как в НСО. Большинство из них связывают один гем, некоторые – два (рис. 17.10).
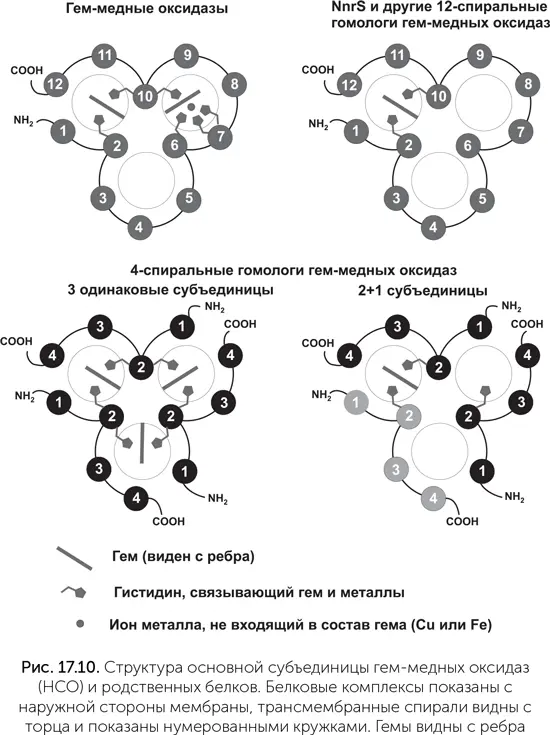
Почти все эти белки известны только из последовательностей полных геномов различных бактерий и никогда не изучались экспериментаторами. Только одна из семи групп HCOH-t попадала в руки экспериментаторов раньше. Это белок NnrS, выделенный из холерных вибрионов. У холерного вибриона он обеспечивает устойчивость к оксиду азота, вырабатываемому иммунной системой хозяина. У почвенных бактерий, где белок NnrS тоже был опознан, он организует движение клеток в сторону большей концентрации нитратов и нитритов. Точный механизм его работы неизвестен, в пробирке NnrS холерного вибриона не окисляет и не восстанавливает NO. Гены nnrS и большинства других родственников НСО в геномах соседствуют с генами ферментов нитратного и нитритного дыхания и генами защиты от отравления NO (не только иммунная система животных, но и сами бактерии травят им друг друга). Так что их функции должны быть как-то связаны с оксидами азота. 4-спиральные НСОН-s явно имеют отношение к предкам НСО, у которых еще не произошло слияния трех белковых субъединиц в одну. Остается ждать, пока биологи-экспериментаторы исследуют разведанные биоинформатиками цели, и тогда мы сможем судить о функциях предков гем-медных оксидаз.
Эволюция фотосистем
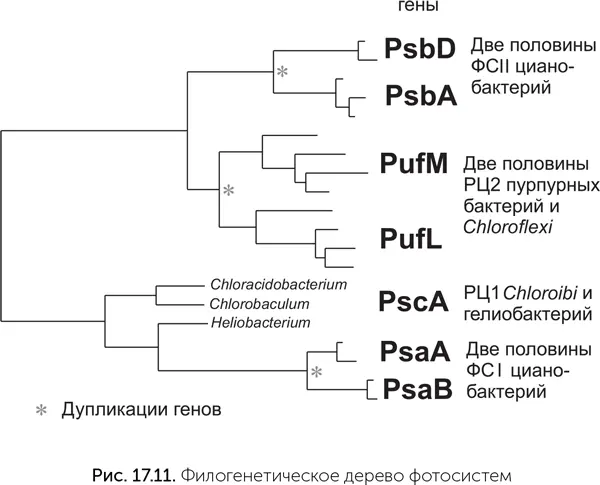
Происхождение фотосистем от простых хлорофилл-связывающих белков с функцией защиты от ультрафиолета не вызывает больших сомнений. Гораздо менее понятно, как появилось два типа фотосистем. Существует две точки зрения. По одной гипотезе (слияния), ФСI и ФСII независимо возникли из светозащитных белков в разных линиях бактерий. В этом случае цианобактерии, имеющие оба типа фотосистем в одной клетке, появились благодаря событию горизонтального переноса генов одной из фотосистем. Другая гипотеза предполагает, что две фотосистемы возникли путем дупликации генов в одной клетке и появления какого-то «разделения труда» между копиями предкового гена. От этой клетки произошли цианобактерии, а потом вторая фотосистема распространилась к другим группам бактерий путем горизонтального переноса генов.
Некоторые указания на порядок появления разных систем фотосинтеза можно найти в устройстве фотосистем. Так, реакционные центры фотосистем обычно состоят из двух белковых субъединиц. Это разные, хотя и родственные белки, возникшие в результате дупликации общего предкового гена. Однако у Chlorobi и гелиобактерий РЦ1 состоит из двух одинаковых субъединиц, т. е. их фотосистемы сохранили предковое состояние, существовавшее до дупликации. РЦ2 пурпурных бактерий и Chloroflexi состоят из двух разных субъединиц, как и ФСII цианобактерий. На филогенетическом дереве видно, что разные субъединицы РЦ2 пурпурных бактерий ближе друг к другу, чем к субъединицам ФСII цианобактерий. Следовательно, две субъединицы РЦ2 пурпурных и две субъединицы ФСII цианобактерий – это результат двух независимых дупликаций генов (рис. 17.11).
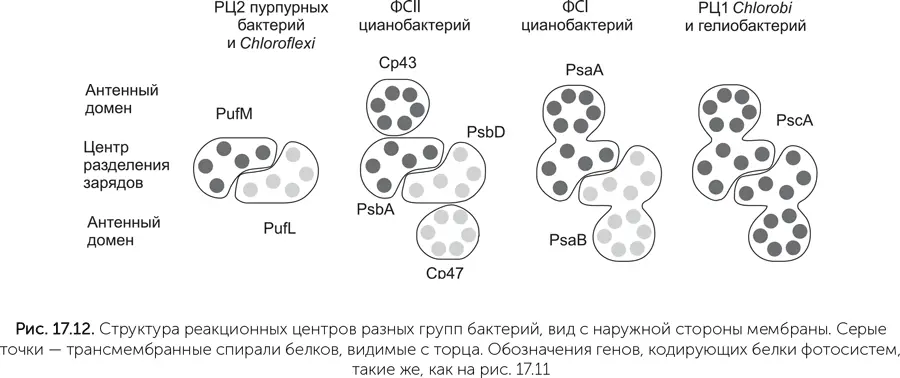
Трехмерная структура фотосистем цианобактерий показывает, что они очень близки по пространственной укладке белка и расположению кофакторов – хлорофиллов, феофитинов, хинонов (Baymann, 2001). Однако есть важное различие: в ФСI реакционный центр (в котором происходит разделение зарядов) и антенная часть являются двумя доменами одной белковой цепи, проходящей через мембрану 11 раз, а в ФСII они разделены на отдельные белковые молекулы, кодируемые разными генами. Антенная часть ФСII образуется белками CP43 и CP47, имеющими шесть трансмембранных спиралей, а реакционный центр – белками D1 и D2 c пятью трансмембранными спиралями (рис. 17.12). По трехмерной структуре CP43/CP47 и D1/D2 соответствуют двум доменам единого белка ФСI.
РЦ1 Chlorobi и гелиобактерий состоит из двух одинаковых белковых молекул с 11 трансмембранными спиралями каждая, образующими антенный домен и центр разделения зарядов, так же как ФСI цианобактерий. Однако РЦ2 пурпурных бактерий и Chloroflexi не имеют ничего похожего на CP43/CP47 и содержат только пять трансмембранных участков. Функции CP43/CP47 выполняют другие антенные белки, не имеющие никаких аналогов у цианобактерий. По аминокислотной последовательности CP43/CP47 цианобактерий больше похожи на антенный домен РЦ1 гелиобактерий, чем на антенну ФСI той же цианобактериальной клетки.
Как нам разобраться, какой вариант фотосистемы древнее – с отдельным антенным белком вроде CP43/CP47 или слитный? Хотя в процессе эволюции происходят как слияния, так и разделения белков, в данном случае гораздо более вероятно разделение предкового двухдоменного белка. Все примитивные варианты фотосистем, состоящие из одинаковых половинок (РЦ1 гелиобактерий и Chloroflexi ), состоят из двухдоменных 11-спиральных белков. Появление ФСII в таком случае должно было произойти у предков цианобактерий, а РЦ2 пурпурных бактерий и Chlorobi , видимо, произошли от ФСII древних цианобактерий путем утраты CP43/CP47 и приобрели новые антенные белки (рис. 17.12).
Есть и другой способ узнать, каким способом появилось два типа фотосистем. Если две фотосистемы развивались независимо в разных группах бактерий, то на филогенетических деревьях разных генов фотосинтеза должен быть виден глубокий раздел на ветви обладателей РЦ1 и РЦ2. Среди генов, относящихся к фотосинтезу, наиболее широко распространены ферменты синтеза хлорофилла. Филогенетические деревья этих ферментов (Sousa et al., 2013, Gupta, 2012) показывают, что такого раздела нет (рис. 17.13). Наоборот, Chlorobi с РЦ1 и Chloroflexi с РЦ2 на этих деревьях очень близки друг к другу, а пурпурные бактерии и вовсе попадают внутрь группы цианобактерий. Ферменты пурпурных бактерий специфически сходны с ферментами так называемой ветви С цианобактерий. Члены этой ветви – мелкие одноклеточные цианобактерии океанского пикопланктона (клетки размером менее 2 мкм), такие как Prochlorococcus и Synechococcus . Иначе говоря, история ферментов синтеза хлорофилла, так же как история белков фотосистем, лучше согласуется с появлением обеих фотосистем у предка цианобактерий и горизонтальным переносом их в четыре другие группы фотосинтетических бактерий.
Читать дальшеИнтервал:
Закладка:







