Сергей Титов - Естествознание. Базовый уровень. 10 класс
- Название:Естествознание. Базовый уровень. 10 класс
- Автор:
- Жанр:
- Издательство:Array Литагент «Дрофа»
- Год:2013
- Город:Москва
- ISBN:978-5-358-13589-5
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Сергей Титов - Естествознание. Базовый уровень. 10 класс краткое содержание
Учебник объединяет сведения об основных законах и закономерностях, наиболее важных открытиях и достижениях в области химии, физики, астрономии, что формирует у учащихся представление о природе как целостной системе, а также о взаимосвязи человека, природы и общества.
Современное оформление, многоуровневые вопросы и задания, дополнительная информация и возможность параллельной работы с электронным приложением способствуют эффективному усвоению учебного материала.
Учебник адресован учащимся 10 класса.
Естествознание. Базовый уровень. 10 класс - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Элементы, которые склонны к отдаче электронов, называют металлами, а те, которые способны их принимать, – неметаллами. Атомы многих элементов, например углерода, серы, примерно с равной вероятностью могут и отдавать, и принимать электроны. Чёткой границы между металлами и неметаллами не существует.
Наиболее распространённым и наглядным примером взаимодействия металлов и неметаллов является процесс, который происходит при контакте щелочного металла с галогеном. Металл легко отдаёт свой единственный внешний электрон, а галоген присоединяет его как единственный недостающий. В результате образуется положительно заряженный ион металла ( катион )и отрицательно заряженный ион галогена (анион) [11]. Имея разноимённые заряды, эти ионы притягиваются друг к другу. В результате получаются соли, примером которой является хлорид натрия (поваренная соль). Хлорид натрия состоит из кристаллов, в состав которых входят катионы натрия Na +и анионы хлора Cl -(рис. 125). При растворении хлорида натрия в воде его кристаллы распадаются на ионы. Процесс распада молекул или ионных кристаллов веществ на ионы при растворении в воде называют электролитической диссоциацией.
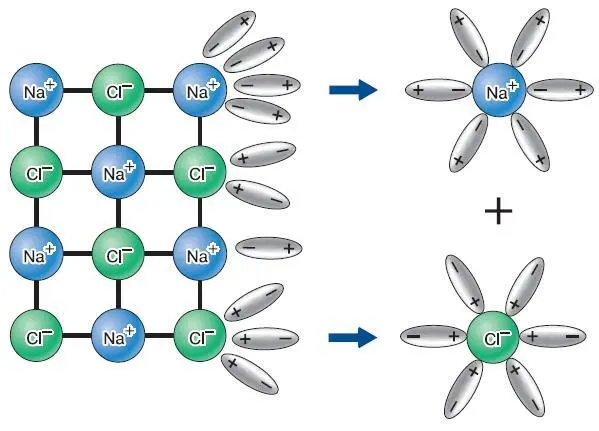
Рис. 125. Схема электролитической диссоциации хлорида натрия
Таким образом, в растворе поваренной соли нет молекул хлорида натрия, а присутствуют только ионы натрия и хлора, окружённые молекулами воды (см. рис. 125). Слово «диссоциация» здесь означает распад, разделение. Вещества, способные к электролитической диссоциации, называют электролитами. Их растворы проводят электрический ток. Это становится понятным, если учесть, что ток – это перенос заряженных частиц, которыми в данном случае являются катионы и анионы. Электролитической диссоциации при растворении в воде подвергается не только соли, но также кислоты и основания.
1. В каких случаях при протекании химических реакций атом чаще отдаёт, а в каких – присоединяет электроны?
2. Почему гелий и другие благородные газы почти не способны вступать в химические реакции?
3. Чем определяются реакции окисления и восстановления?
Опираясь на рисунок 125, опишите, какую роль играет вода в процессе электролитической диссоциации.
§ 49 Валентность. Химическая связь
Внешняя электронная оболочка атома, которая соответственно и определяет его химические свойства, может содержать не более восьми электронов. Исключение составляют только атомы водорода и гелия, на единственной орбитали которых может находиться не более двух электронов. С помощью внешних электронов, которые называют валентными, осуществляется химическая связь между атомами, и образуются химические соединения. Электронную оболочку, содержащую валентные электроны, называют валентной оболочкой. Слово валентность (от лат. valentia – сила) означает способность атома образовывать определённое число химических связей с другими атомами. Валентность атома определяется числом имеющихся у него валентных электронов.
У атомов элементов каждого нового периода Периодической системы Д. И. Менделеева возникает новая валентная оболочка, которой не было у атомов элементов предыдущего периода. Элементы IIIА группы – щелочные металлы – содержат на этой оболочке всего один электрон. Их атомы легко отдают этот единственный электрон, поэтому все щелочные металлы одновалентны и химически очень активны. По мере увеличения порядкового номера элемента в периоде происходит постепенное заполнение валентной оболочки. Так, элементы IIА группы содержат на внешнем уровне два электрона, IIIА группы – три электрона и т. д. Галогены находятся в VIIA группе, следовательно, их атомы содержат семь валентных электронов. Благородные газы, стоящие в конце периода в VIIIA группе (например, неон, аргон, криптон, ксенон), содержат по восемь валентных электронов. Их внешняя оболочка заполнена, поэтому они почти не обладают химической активностью. После заполнения валентной оболочки (в конце периода) у следующего элемента возникнет новая оболочка.
Процесс обмена электронами между атомами и является причиной возникновения химической связи. Один из видов химической связи – ионная связь. Это связь, возникающая между ионами в результате действия электростатических сил притяжения (рис. 126). Типичным примером вещества с ионной связью является хлорид натрия. Однако это не единственный вид химической связи. Рассмотрим молекулу, состоящую из одинаковых атомов, например молекулу водорода, имеющую формулу Н 2. Каким образом два атома водорода соединяются между собой? Мы знаем, что на единственной 1 s -орбитали атома водорода могут находиться два электрона. Однако атом водорода имеет всего один электрон, и для заполнения оболочки ему нужен ещё один. В таком же положении находится и второй атом водорода.
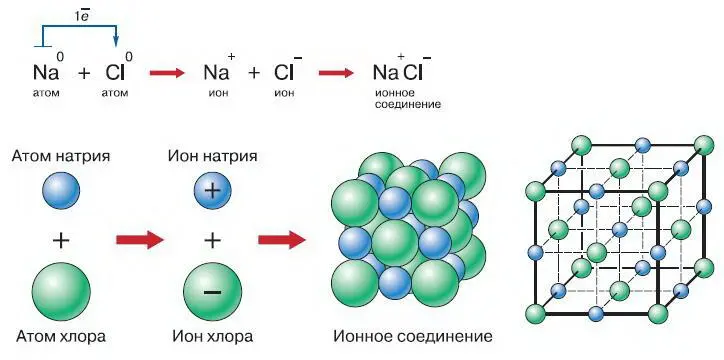
Рис. 126. Образование ионной связи
Поэтому они как бы «договариваются» пользоваться имеющимися в их распоряжении двумя электронами сообща. Теперь в их распоряжении имеется общая орбиталь, заполненная, как ей и полагается, двумя электронами. Такая молекула обладает очень высокой устойчивостью.
Химическую связь, при которой атомы обобществляют свои валентные электроны, называют ковалентной (рис. 127, 128). В зависимости от количества общих электронных пар ковалентная связь может быть одинарной, двойной, а иногда и тройной. Многие химические вещества построены из молекул, состоящих из атомов двух элементов, одним из которых является атом кислорода. Такие вещества называются оксидами. К оксидам относятся такие хорошо известные вам вещества, как углекислый газ СО 2, вода Н 2О и многие другие. При образовании оксидов кислород, у которого для заполнения валентной оболочки не хватает двух электронов, охотно образует две общие электронные пары с атомами других элементов, образуя с ними двойную ковалентную связь. А вот тройные связи встречаются в химических соединениях гораздо реже и образуются преимущественно между атомами углерод – углерод, углерод – азот и азот – азот.
Многие элементы во всех соединениях проявляют одинаковую валентность. Так, водород и щелочные металлы всегда одновалентны, а кислород всегда двухвалентен. Существуют, однако, элементы с переменной валентностью. Одним из рекордсменов среди таких элементов является хлор, который находится в VIIА группе периодической системы. Хлор способен проявлять валентности от I до VII, и образует многочисленные и самые разнообразные соединения.
Читать дальшеИнтервал:
Закладка:










