Артем Благодатский - Open Longevity. Как устроено старение и что с этим делать
- Название:Open Longevity. Как устроено старение и что с этим делать
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2022
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Артем Благодатский - Open Longevity. Как устроено старение и что с этим делать краткое содержание
Open Longevity. Как устроено старение и что с этим делать - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Подробнее о сшивках в матриксе
Изменения в структуре матрикса связывают в первую очередь с таким химическим процессом, как образование поперечных сшивок между его волокнами. Отметим несколько основных механизмов образования сшивок:
1. Ферментативное: с помощью трансглутаминазы 47и лизилоксидазы 48(рис. 2).
2. Неферментативное: 2а) гликирование белков; 2b) спонтанное расщепление по остатку аспарагина.
3. Карбамилирование.
Гликирование белков
Гликирование – неферментативное присоединение моносахаридов (глюкозы, фруктозы или их производных) к свободной аминогруппе белка с образованием химической сшивки (рис. 4). Химическое название данной реакции – реакция Майяра.
Если говорить простыми словами, это реакция «прилипания сахаров к белкам». Мы часто наблюдаем ее в быту: именно благодаря реакции Майяра при запекании получается аппетитная корочка на шашлыке или хлебе. Без дополнительного «поджаривания» реакция Майяра, впрочем, тоже протекает, просто медленнее – ровно это и происходит в нашем организме.
Вещества на корочке хлеба называются конечными продуктами гликирования (КПГ). Конечными в том смысле, что они получаются в конце реакции. И в том смысле, что назад дороги нет, корочка не превратится обратно в сырой хлеб.
Наличие КПГ в нашем теле – это на самом деле проблема, так как такие слипшиеся с моносахаридами белки перестают выполнять свои функции, а вернуться в нормальное функциональное состояние самостоятельно уже не могут. КПГ – это мусор, от которого необходимо избавиться, так как их накопление ведет к росту уровня воспаления в организме (к запуску экспрессии провоспалительных цитокинов) 49.
В целом гликирование неполезно – это своего рода химическое «изнашивание» белков. Его даже можно считать маркером времени жизни белка 50. Это случайный, стохастический процесс, происходящий в нашем теле безо всякой на то генетической программы.
Именно гликирование – виновник большинства повреждений тканей при сахарном диабете 51. Кроме того, гликирование может приводить к нарушению функций митохондрий, их структуры и к окислительному стрессу 52. Повышенное содержание КПГ обнаруживается в нервных клетках пациентов, страдающих болезнью Альцгеймера 53, что указывает на участие гликирования в ее патогенезе 41. Оно ускоряет процесс дегенерации нейронов, наблюдаемый при болезни Паркинсона 54.
Гликирование же коллагена I типа делает его устойчивым к «перестройке» ферментами. Более того, между волокнами коллагена формируются «механические» сшивки, что увеличивает жесткость матрикса 21, 55.
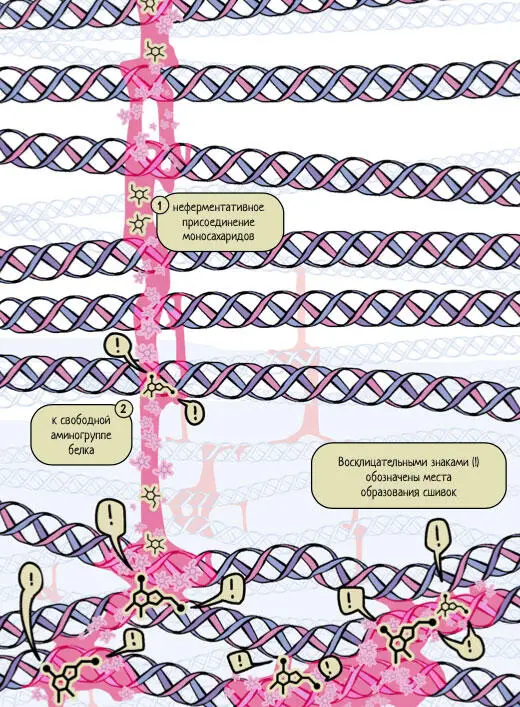
Рисунок 4.Схематичное изображение процесса гликирования белков: неферментативное присоединение моносахаридов (1) к свободной аминогруппе белка (2). Восклицательными знаками (!) обозначены места образования сшивок
Диагностика гликирования
Сейчас КПГ уже используются в клинической практике в качестве диагностического маркера для целого ряда заболеваний [12] К примеру, гликированный гемоглобин (HbА1c) применяют в качестве маркера диабета 1-го и 2-го типов 57 . Однако из-за относительно большого времени полураспада (порядка 120 дней 58 ) этот показатель плохо характеризует недавние изменения в тканях. По этой причине параллельно измеряют уровень гликирования альбумина в сыворотке крови, период полураспада которого значительно меньше (порядка 20 дней 59 ). Эти анализы используют при диагностике гипертонии, ожирения и острых воспалительных заболеваний. Гликированные липопротеины высокой и низкой плотности позволяют с высокой точностью предсказывать развитие ишемической болезни сердца, а также появление симптомов атеросклероза 60 .
56.
В частности, проводят анализ уровня гликирования белков в тканях, что важно для отслеживания изменений в долгосрочной перспективе. Это актуально и для коллагена, период полураспада которого – несколько лет, а уровень гликирования у здоровых людей в возрасте от 20 до 80 лет растет, хоть и незначительно, со временем 61.
Обычно для кожи, как самой богатой коллагеном ткани, определяют уровень содержания глюкозепана (одного из КПГ). В ряде работ показана взаимосвязь роста количества глюкозепановых сшивок с сердечно-сосудистыми заболеваниями 62, 63и заболеваниями нервной системы 62. Увеличение скорости гликирования коллагена говорит о развивающихся нарушениях, таких как кальцификация коронарных артерий, ретинопатия, нейропатия или нефропатия 64.
В целом же наиболее перспективное направление развития предсказательной диагностики гликирования белков – комбинирование большого количества различных анализов в сочетании с приемами машинного обучения. Уже сейчас такие подходы 65показывают первые результаты в диагностике аутизма.
Еще один механизм образования сшивок
Он был открыт совсем недавно и включает в себя первоначальное спонтанное расщепление по остатку аспарагина в белке со ступенчатым расщеплением С-концевого сукцинимида, что в конечном счете приводит к образованию ангидрида. Нуклеофильная «атака» на этот ангидрид боковой аминогруппой лизина приводит к образованию ковалентной изопептидной связи.
Любой остаток аспарагина в белке, по-видимому, является потенциальным сайтом такого ковалентного сшивания 66(рис. 5).
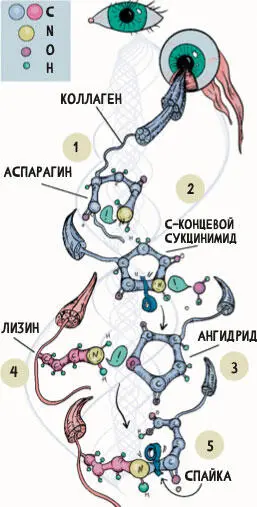
Рисунок 5.Один из механизмов образования сшивок в матриксе 66
Первоначально остаток аспарагина (1) в белке подвергается спонтанному расщеплению, что приводит к формированию С-концевого сукцинимида (2), ступенчатое расщепление которого в конечном счете приводит к образованию ангидрида (3). Нуклеофильная «атака» на этот ангидрид боковой аминогруппой лизина (4) приводит к образованию ковалентной изопептидной связи (5). Любой остаток аспарагина в белке, по-видимому, – потенциальный сайт такого ковалентного сшивания.
Карбамилирование
Гликирование – не единственный тип химических реакций, ускоряющих старение матрикса. Группа французских исследователей показала 67, что важным маркером старения является также карбамилирование – присоединение к аминогруппам белков остатков изоциановой кислоты, одного из продуктов распада мочевины (рис. 6).
При карбамилировании остатков лизина в долгоживущих белках матрикса накапливается гомоцитруллин. Его содержание напрямую коррелирует с продолжительностью жизни мышей, коров и людей.
Наличие гомоцитруллиновых остатков в молекулах коллагена приводит к дестабилизации его трехспиральной структуры и, как следствие, к снижению его устойчивости к температуре, действию металлопротеиназ и другим факторам деградации.
Читать дальшеИнтервал:
Закладка:










