Джейми Метцль - Взломать Дарвина: генная инженерия и будущее человечества
- Название:Взломать Дарвина: генная инженерия и будущее человечества
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2021
- Город:Москва
- ISBN:978-5-17-122544-5
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Джейми Метцль - Взломать Дарвина: генная инженерия и будущее человечества краткое содержание
Джейми Метцль считает, что не стоит полагаться на «слепого часовщика», имея в руках возможность управлять геномом, словно программным кодом. Эволюция, поставленная под контроль, даст человеку возможность не только искоренить некоторые болезни, но и стать более совершенным – и счастливым. Стоит лишь выбрать наиболее удачную конфигурацию генов. Однако такой сценарий неизбежно сопряжен с рисками: мы можем лишиться гена, важности которого еще не понимаем; общество потенциально поделится на «генетически имущих и неимущих»; государства начнут войну за технологии. Именно поэтому разработка генетической этики должна вестись параллельно с лабораторными исследованиями.
Изменение человечества на генетическом уровне – уже не научная фантастика, а естественное следствие развития биотехнологий. Настало время вооружиться фактами.
В формате PDF A4 сохранён издательский дизайн.
Взломать Дарвина: генная инженерия и будущее человечества - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Поняв, как автоматизировать этот процесс и улучшить считывание световых вспышек, проходящих по «буквам» ДНК, исследователи Ли Худ и Ллойд Смит смогли увеличить скорость и эффективность секвенирования, а также заложить основу для еще одного шага вперед. В 1988 году Национальный институт здравоохранения США запустил глобальную кампанию по активной разработке следующего поколения машин, секвенирующих ДНК, и она стала плацдармом для еще более амбициозных кампаний по расшифровке всего генома [9] Почитать про техническую составляющую секвенирования ДНК можно в работе James M. Heather, Benjamin Chain. The Sequence of Sequencers: The History of Sequencing DNA // Genomics 107. – Vol. 1 (2016): 1–8. – doi:10.1016/j.ygeno.2015.11.003.
.
Проект «Геном человека» – амбициозная попытка мировых ученых под руководством США секвенировать и создать карту первого генома человека – обошелся в 2,7 миллиарда долларов и длился целых 13 лет, его завершили в 2003 году. К этому времени частная компания, возглавляемая ученым и предпринимателем Крейгом Вентером, придумала альтернативный способ секвенирования генома – не столь масштабный, но более быстрый, чем правительственный вариант. Обе этих программы стали колоссальным скачком для человечества, и дальнейшее развитие не прекращалось. Появление таких компаний, как Illumina в Сан-Диего или BGI-Shenzhen в Китае, превратило секвенирование генома в конкурирующую, быстро развивающуюся и многомиллиардную глобальную индустрию. Следующее поколение нанопоровых секвенаторов, которые под действием тока пропускают ДНК через крошечные отверстия в белках и считывают с них содержимое, как с телеграфной ленты, может стать еще большим революционным прорывом [10] John J. Kasianowicz, Sergey M. Bezrukov. On Three Decades of Nanopore Sequencing // Nature Biotechnology . – Vol. 34 (2016). – PP: 481–482.
.
По мере того, как технологии становились точнее и мощнее, их стоимость стремительно снижалась. График ниже показывает, как резко снизилась стоимость секвенирования генома за последние 15 лет.
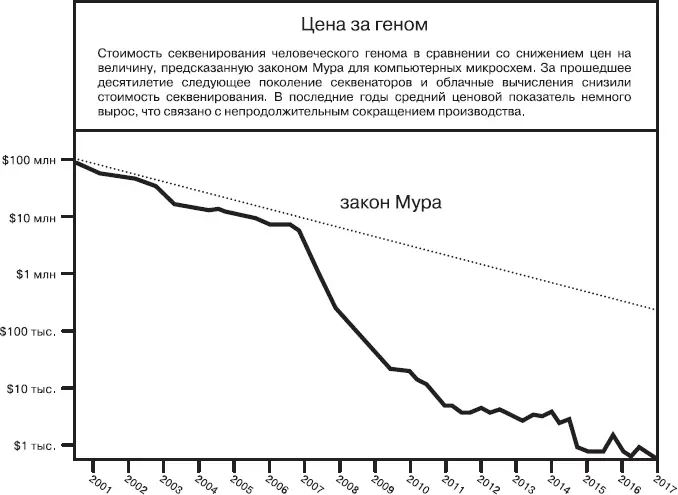
Источник: The Cost of Sequencing a Human Genome, NIH, дата последнего изменения 6 июля 2016 года, https://www.genome.gov/27565109/the-cost-of-sequencing-a-human-genome/.
Сегодня секвенирование всего генома выполняют за день, и оно стоит порядка 700 долларов. В начале 2017 года генеральный директор Illumina Фрэнсис де Соуза объявил, что в недалеком будущем его компания планирует секвенировать целый геном за 100 долларов. По мере того, как стоимость секвенирования приближается к затратам на материалы, а само секвенирование оказывается все более доступным, за меньшие деньги вы можете получить все больше данных. А поскольку геномика – это настоящий полигон для больших массивов данных, увеличение объема и удешевление данных заложат основу для важных открытий.
Но даже если секвенирование станет повсеместным, обыденным и бесплатным, это ничего не изменит, если ученые не научатся понимать язык геномов.
Если бы марсианка прилетела на Землю, желая выяснить, как люди структурируют информацию, ей бы пришлось узнать, что у нас есть определенные вещи, которые мы называем «книги». Затем ей пришлось бы понять, что такие книги состоят из страниц, которые заполнены словами, а те, в свою очередь, образуются из букв. Точно так же и мы узнали, что ДНК находится в генах, упакованных в хромосомы, кодирующие белки и инструктирующие клетки о дальнейших действиях. Если бы марсианка захотела понять, что сказано в книгах, ей пришлось бы разобраться, что означают слова и как их читать. Аналогично, когда ученые вывели основы организации генов, еще предстояло понять, чем на самом деле эти гены занимаются.
Хорошая новость заключается в том, что у ученых много козырей в рукаве. По мере того, как исследователи секвенировали геномы отдельных червей, мух, мышей и прочих сравнительно простых «модельных организмов», чтобы разобраться в общих биологических процессах, ученые пытали сопоставить различия между схожими типами организмов и непохожесть их генов. Сформулировав гипотезу, они стали выводить организмы с одинаковыми генетическими мутациями, чтобы выяснить, будут ли проявляться те же признаки у потомства. Со временем ученые научились включать и выключать различные гены в живых организмах и наблюдать, как в результате менялись отдельные признаки. Они использовали усовершенствованные вычислительные инструменты, чтобы анализировать взаимодействие генов, и проводили более масштабные исследования ассоциаций, чтобы обработать еще большие наборы генетических данных.
Даже если бы вся биология опиралась только на экспрессию генов, расшифровать наборы генетических данных было бы довольно трудно. Однако все намного сложнее. Сам по себе геном – это невероятно сложная экосистема, которая взаимодействует как с другими сложными системами внутри организма, так и с изменяющейся средой вокруг. Экспрессия одного гена приводит к проявлению только небольшого процента признаков или заболеваний. Большинство же из них обусловлено группой генов, работающих сообща и взаимодействующих с окружающей средой.
По сути, никто не знает точного числа, но было подсчитано, что в определении сложных признаков, например интеллекта, веса и типа личности, играют роль сотни или тысячи генов. Они не работают в одиночку. Рибонуклеиновая кислота, или РНК, которая когда-то считалась проводником между ДНК и клеточным механизмом по производству белка, теперь признана важным участником экспрессии. Эпигенетические метки помогают определить, как гены делают это. На первых этапах изучения геномики понять, как эти перекрестные процессы влияют на сложные генетические признаки, было необычайно сложно. И все же обозначить сравнительно небольшой процент признаков и болезней, обусловленных мутациями одного гена, было немного проще.
Муковисцидоз, болезнь Гентингтона, мышечная дистрофия, серповидно-клеточная анемия, болезнь Тея – Сакса – все это примеры заболеваний, вызванных мутацией одного гена. Также они известны как менделевские заболевания , потому что четко следуют законам генетического наследования. Какие-то из этих заболеваний называются доминантными , поскольку в этом случае ребенку достаточно унаследовать только одну копию мутации от родителя с той же патологией. В случае же таких рецессивных патологий, как болезнь Тея – Сакса, ребенок должен унаследовать мутацию от обоих родителей. (В редких случаях люди с подобными мутациями не наследуют определенное заболевание, чаще всего потому, что эту мутацию сдерживают другие гены.) Из примерно 25 000 уже известных менделевских заболеваний около 10 000 изучены на достаточном уровне, позволяющем связывать с проявлением определенного заболевания определенный ген [11] Статистика из онлайн-базы данных OMIM, дата последнего изменения – 24 июля 2018 года. URL: http://www.omim.org/statistics/entry.
. На сегодняшний день лечению поддаются лишь 5 % подобных мутаций.
Интервал:
Закладка:








