Сергей Огнивцев - Борьба со старением, или Не все мы умрем…
- Название:Борьба со старением, или Не все мы умрем…
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2021
- ISBN:978-5-532-98497-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Сергей Огнивцев - Борьба со старением, или Не все мы умрем… краткое содержание
Борьба со старением, или Не все мы умрем… - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Несколько электронов, взаимодействуя, образуют причудливые конфигурации, каждая из которых может характеризоваться определенной потенциальной энергией. Мир устроен так, что наиболее устойчивыми являются конфигурации с максимально заполненными внешними электронными оболочками [29] Полная заполненнность внешней электронной оболочки соответствует инертному газу, например гелию с двумя электронами или неону с восемью электронами.
. Такую конфигурацию имеют инертные газы, и заполненные внешние электронные оболочки придают им устойчивость и, следовательно, инертность, то есть нежелание вступать в какие-либо химические взаимодействия. Все остальные атомы стремятся совместно с другими атомами создать такие же устойчивые, как у инертных газов, электронные оболочки .
Образуя молекулы, атомы элементов притягивают к себе электроны с разной силой, прямо пропорциональной их электроотрицательности [30] Электроотрициательность – это способность атома притягивать электроны других атомов.
. Металлы имеют электроотрицательность на уровне 1, такие неметаллы, как углерод, сера, бром, водород, и металлы – медь, цинк, железо – электроотрицательность, близкую к 2, такие неметаллы, как фтор и хлор, – на уровне 3 и 4.
Существует несколько типов химических связей между элементами. Все химические связи вызваны одной единственной силой электростатического притяжения, или кулоновской силой . Все связи объясняются перетягиванием электронов от одного атома к другому.
Если молекулу образуют элементы с высокой и низкой электроотрицательностью, например, Na и Cl, то элемент с высокой электроотрицательностью (Cl) перетягивает электрон на свою электронную орбиту и сам становится отрицательным. При этом элемент с низкой электроотрицательностью остается без своего электрона и становится положительном. Положительный и отрицательный заряды притягиваются и образуют весьма устойчивую связь, именуемую ионной , поскольку фактически притягиваются положительный ион Na +и отрицательный ион Cl -.
Ковалентная связь (основная химическая связь в органических соединениях) образуется при взаимодействии атомов, электроотрицательности которых отличаются незначительно. Такая связь возникает в результате обобществления валентных (находящихся на внешней оболочке) электронов, которые до образования связи принадлежали двум атомам. В процесс обобществления могут вовлекаться не только два, но и четыре, и шесть электронов. В результате образуется устойчивая электронная конфигурация инертного газа, например для воды.
Из рисунка 1.2.2 видно, что в такой конфигурации у кислорода имеется внешняя оболочка, заполненная до инертного газа неона (8 электронов), а у водорода – до инертного газа гелия (2 электрона). При этом образовавшаяся устойчивая конструкция несимметрична. Молекула воды представляет собой диполь : та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, – отрицательно.
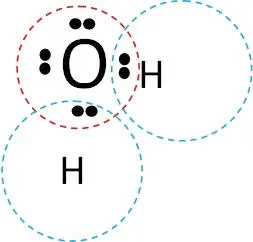
Рис. 1.2.2. Ковалентная связь молекулы воды
Связываясь с атомом наиболее электроотрицательных элементов (фтор, кислород, хлор и азот), атом водорода приобретает положительный заряд. При этом в отличие от других атомов водород, отдавший электрон, является ядром, абсолютно лишенным электронной оболочки. Размеры ядра в тысячи раз меньше размера атома. Поэтому водород может подойти очень близко к другим атомам – электронная оболочка ему уже почти не мешает. Если рядом находится другой диполь, водород притянется к его отрицательному концу. Так образуется водородная связь. Она в 4–10 раз менее прочна, чем ковалентная и ионная. Водородные связи часто встречаются в молекулах белков, нуклеиновых кислот и других биологически важных соединений, поэтому эти связи играют важную роль в биохимии.
Ковалентная и водородная связи составляют основу биохимии . Используя ковалентную связь, аминокислоты могут связываться в огромные по размеру и весьма сложные белки [31] Белок мышцы человека титин состоит из 38138 аминокислот. Это самый большой из известных белков.
.
Для наиболее продвинутых и любознательных читателей поясним, что для построения сложных белков служит ковалентная связь между атомами азота и углерода.
От одной аминокислоты с конца COOH (карбоксила) отщепляется – OH, а от конца с NH 2(аминогруппы) – другой – H, из них образуется вода (H-O-H, или хорошо знакомая всем H 2O). Освободившиеся при этом электроны образуют ковалентную связь между C и N. Ковалентную связь между двумя аминокислотами принято называть пептидной [32] Для тех, кто окончательно забыл школьный курс органической химии, напомним, что на схеме черточка, соединяющая два элемента, обозначает связь, в которой участвуют два электрона.
.
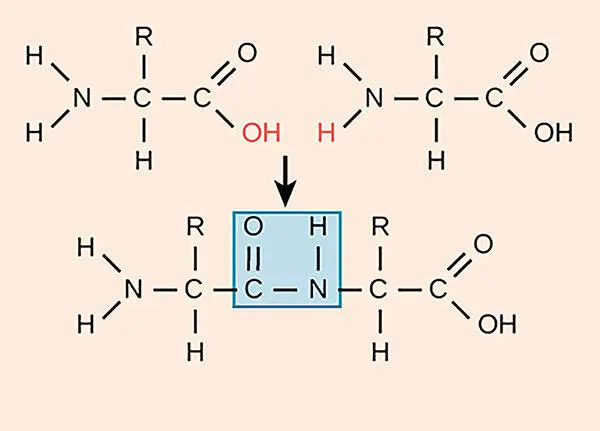
Рис. 1.2.3. Образование пептидной (ковалентной) связи между двумя аминокислотами
В белковых цепях атомы водорода, ковалентно связанные с атомами азота (левый конец на рисунке 1.2.3), взаимодействуют с атомами кислорода соседней цепи или другого участка этой же цепи (справа) и образуют водородную связь . Все сложные белки содержат сотни водородных связей, которые сворачивают их в причудливые формы (шары, спирали и т. д.).
Водородная связь играет важнейшую роль в построении молекул ДНК и РНК, задающих и передающих генетический код. ДНК состоит из четырех типов элементов, которые называют нуклеотидами .
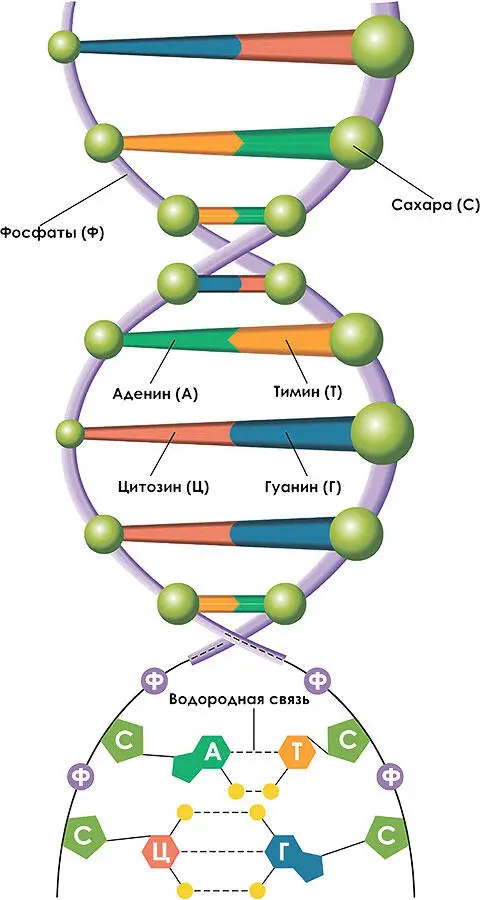
Рис. 1.2.4. Двойная спираль ДНК
Каждый нуклеотид состоит из одинакового для всех связующего звена, состоящего из сахара и остатка фосфорной кислоты, и одного из четырех разных кодирующих элементов: аденина, гуанина, тимина или цитозина . Связующие элементы создают между собой прочные ковалентные связи (азот – углерод), вместе образующие спираль, напоминающую штопор. Кодирующие элементы связываются друг с другом водородными связями: аденин с тимином двумя водородными связями, а гуанин и цитозин – тремя. Через мостики кодирующих элементов две спирали ДНК связываются, образуя двойную спираль с перемычками, напоминающую лесенку (рис. 1.2.4).
Так устроена основная молекула жизни!
РНК отличается от ДНК незначительно . Во-первых, в качестве связующего звена используется другой тип сахара – не дезоксирибоза, а просто рибоза. Во-вторых, вместо тимина РНК использует другое основание – урацил.
Читать дальшеИнтервал:
Закладка:





![Сергей Курашов - Борьба за огонь. Сборник рассказов [litres самиздат]](/books/1149398/sergej-kurashov-borba-za-ogon-sbornik-rasskazov.webp)




