Феликс Филатов - Клеймо создателя
- Название:Клеймо создателя
- Автор:
- Жанр:
- Издательство:Литагент «Ридеро»78ecf724-fc53-11e3-871d-0025905a0812
- Год:неизвестен
- ISBN:978-5-4474-2574-6
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Феликс Филатов - Клеймо создателя краткое содержание
Книга доктора биологических наук Ф. П. Филатова «Клеймо создателя» посвящена одной из версий происхождения жизни на Земле, аргументированной формальными особенностями генетического кода. Эта версия может оказаться также решением парадокса Ферми о существовании разумной жизни за пределами нашей звездной системы. Книга располагает к фундаментальным размышлениям, и ее с интересом прочтут биологи, математики, философы – все, кто интересуется космологией вообще.
Клеймо создателя - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
В новой таблице хорошо разделяются кодоны октетов 1 и 2; последние образуют светлую фигуру «креста», в которой, в свою очередь, хорошо заметно симметричное – относительно центра фигуры – расположение нечетных групп вырожденности и триплетов, дополняющих в октете 2 кодирование аминокислот S, Lи R, имеющих свои кодоны в октете 1.
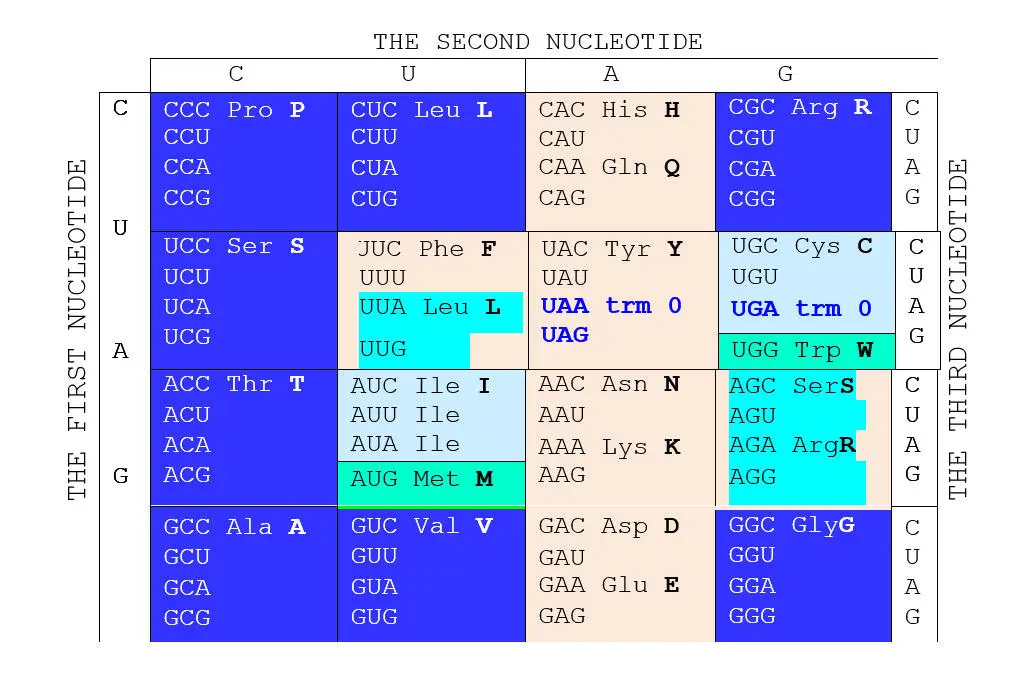
Упорядочивание кодируемых аминокислот по массе неожиданно выявляет еще одну группу симметрий, которые связаны с классом аминоацил-тРНК-синтетаз (АРСаз), присоединяющих аминокислоту к тРНК. АРСазы делятся на два класса на основе структурного сходства и способу аминоацилирования тРНК. АРСазы 1-го класса (АРСазы-1) в большинстве случаев мономеры. 76-й аденозин тРНК они аминоацилируют по 2» -ОН группе. АРСазы-2 – это, как правило, димеры. За исключением фенилаланил-тРНК-синтетазы все они аминоацилируют 76-й аденозин тРНК по 3» -ОН группе. Оба класса АРСаз содержат равное число ферментов – по десять в каждом. Кроме того, АРСазы-1 узнают «свою» тРНК со стороны так называемого «малого желобка» акцепторной миниспирали, а АРСазы-2 – со стороны «большого».
Разделим по аналогии с АРСазами-1 и -2 – соответствующие им аминокислоты также на два класса арс-1 и арс-2. При этом возникает внятная билатеральная симметрия двадцатки аминокислот: ровно половина из них (мы здесь не вдаемся в детали), синтезируется с помощью аминоацил-тРНК-синтетаз (АРСаз) I класса:
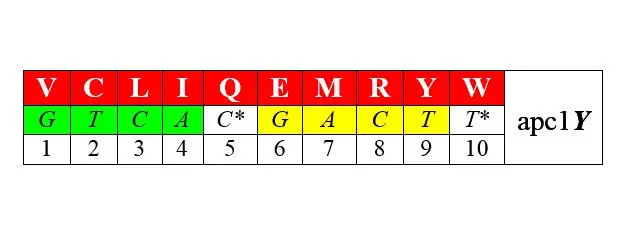
Другая половина синтезируется с помощью АРСаз II класса (нижние строки – порядковые номера аминокислот при раздельной – по классам [1—10 и 1—10] и при сплошной [1—20] их нумерации):
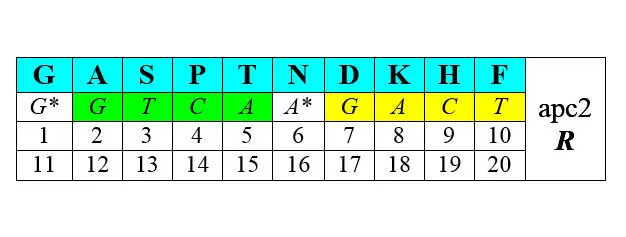
В обоих представленных рядах аминокислоты упорядочены по нарастанию молекулярной массы. Любопытно, что в каждый арс-класс попадает по три неполярные алифатические аминокислоты (V LIи GAP), по три полярные незаряженные ( CQMи STN), по одной негативно и позитивно заряженных ( E-R+и D-K+) и по две ароматические ( YWи HF) аминокислоты. В каждой из строк первых букв кодирующих эти аминокислоты триплетов легко различаются две четверки GTCA и GATC , разделенные в одном случае пиримидинами С* и Т* , в другом – пуринами G* и А* . Поэтому арс-1 мы условно называем пиримидиновыми аминокислотами арс- Y , а арс-2 – пуриновыми , арс- R . Как это может соотноситься с молекулярной биологией процессов, связанных с трансляцией, мы увидим далее.
Описанные симметрии рядов арс- Y и арс- R сохраняются и в двумерном (2D) представлении. Это представление, образно (то есть, не математически) названное Автором базовой матрицей генетического кода, формируется абсциссой, вдоль которой размещаются аминокислоты, упорядоченные по нарастанию молекулярных масс, и ординатой, вдоль которой размещаются первые кодирующие основания, соответствующие этим аминокислотам.
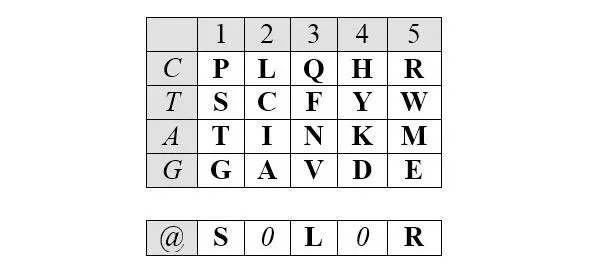
Базовая (без нижней дополнительной строки) матрица является прямоугольником 4х5, содержащим двадцатку канонических аминокислот. В отличие от каллигаммы, матрица не требует специального допущения для кодирования цистеина и, таким образом, полностью соответствует универсальному генетическому коду. Центральные колонки матрицы отчетливо структурированы по гидрофильности аминокислот (в таблице ниже – светлые ячейки заняты гидрофобными аминокислотами, темные – гидрофильными):
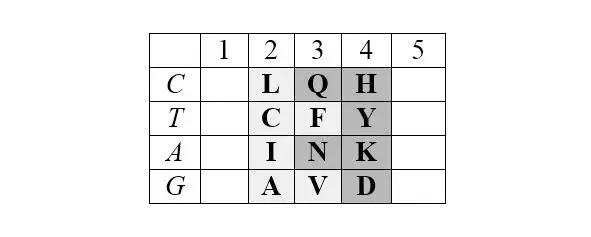
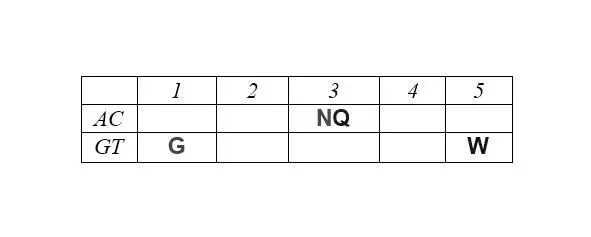
Матрица структурирована также по позициям обозначенных выше четверок аминокислот обоих арс-классов, демонстрируя их строгую сдвиговую симметрию:
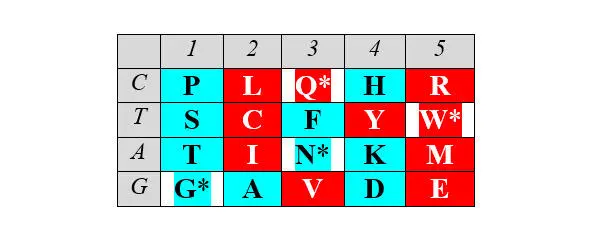
Отчетливо заметна и симметрия продуктов, маркирующих деление арс-классов аминокислот на «пуриновые» и «пиримидиновые», – относительно центральной колонки матрицы:
Поскольку в каждой строке матрицы не более двух или трех аминокислот одного класса с хорошо различимой массой, то при способности АРСаз узнавать хотя бы первое основание кодона (третье – антикодона) и отличать его от фиксированного по массе реперного соседа, безошибочное узнавание АРСазой «своей» тРНК чрезвычайно упрощается. Таким образом, матрица хорошо иллюстрирует решение парадокса множественного узнавания небольшой молекулы с почти монотонной структурой.
Заканчивая главу, упомянем еще об одной нашей находке, имеющей отношение к кодовым симметриям. Оказывается, продукты кодирования зеркально-симметричными дублетами (типа ABN и BAN ) следуют трем простым правилам:
при нарастании массы оснований в дублете кодируемый продукт имеет б о льшую молекулярную массу, при снижении – меньшую;
молекулярная масса продукта, кодируемого гомотриплетом (то есть, ССС , ТТТ , ААА , GGG ), больше, если триплет составлен из пиримидинов;
молекулярная масса пары аминокислот, кодируемых гомодублетом (то есть, СС -, ТТ -, АА -, GG -), больше, если он состоит из пиримидинов.
Возникает вопрос, какой смысл – и есть ли он – в кодовых симметриях и соотношениях, описанных в этой главе? Если хиральность биологических молекул и клеточная организация имеют очевидные достоинства и являются необходимыми для возникновения жизни и последующей эволюции, то симметрия (в первую очередь, билатеральная) генетического кодирования, по меньшей мере, озадачивает. Является ли она следствием каких-то не открытых еще физических или информационных законов (например, исходных альтернатив, выбор которых имел селективные преимущества, похоронившие первые версии кода, значительно более разнообразные и не столь регулярные)? Имеет ли она отношение к надмолекулярным симметриям биологических форм? Нужна ли подобная симметрия кода для его невероятной стабильности или для максимальной простоты и надежности его функционирования в биологических системах? Положительные ответы на все эти вопросы весьма соблазнительны, но без весьма основательной проработки – остаются лишь гипотезами, доказательства которых сегодня даже не просматриваются. Альтернативная точка зрения (Френсис Крик) заключается в том, что все эти симметрии совершенно случайны, и генетический код мог быть каким угодно: химического соответствия между аминокислотами и антикодонами нет. И если сегодня – в большинстве случаев – нельзя рассчитывать на то, что после замены антикодона на другой в синтезируемый полипептид войдет аминокислота, соответствующая новому антикодону, то это потому только, что длительная эволюция – опять-таки во многих случаях – оптимизировала соответствие АРСаз и тРНК за счет участков, выходящих за пределы антикодона.
Читать дальшеИнтервал:
Закладка:









